Oxígeno | elemento químico
El oxígeno es un elemento químico. Tiene el símbolo O y el número atómico 8. Es el tercer elemento más común en el universo, después del hidrógeno y el helio.
El oxígeno constituye más de una quinta parte de la atmósfera terrestre en volumen. En el aire, dos átomos de oxígeno suelen unirse para formar el dioxígeno (O
2), un gas incoloro. Este gas suele llamarse simplemente oxígeno. No tiene sabor ni olor. Es de color azul pálido cuando es líquido o sólido.
El oxígeno forma parte del grupo calcogénico de la tabla periódica. Es un no metal muy reactivo. Forma óxidos y otros compuestos con muchos elementos. El oxígeno en estos óxidos y en otros compuestos (sobre todo los minerales de silicato, y el carbonato de calcio en la piedra caliza) constituye casi la mitad de la corteza terrestre, en masa.
La mayoría de los seres vivos utilizan el oxígeno en la respiración. Muchas moléculas de los seres vivos tienen oxígeno, como las proteínas, los ácidos nucleicos, los carbohidratos y las grasas. El oxígeno forma parte del agua, que toda la vida conocida necesita para vivir. Las algas, las cianobacterias y las plantas fabrican el gas oxígeno de la Tierra mediante la fotosíntesis. Utilizan la luz del Sol para obtener hidrógeno del agua, desprendiendo oxígeno.
En la parte superior de la atmósfera terrestre se encuentra el ozono (O
3), en la capa de ozono. Ésta absorbe la radiación ultravioleta, por lo que llega menos radiación al nivel del suelo.
El gas oxígeno se utiliza para fabricar acero, plásticos y textiles. También tiene usos médicos y se utiliza para respirar cuando no hay aire bueno (por los buzos y los bomberos, por ejemplo), y para soldar. El oxígeno líquido y los compuestos ricos en oxígeno pueden utilizarse como propulsor de cohetes.
Historia
El gas oxígeno (O
2) fue aislado por Michael Sendivogius antes de 1604. A menudo se piensa que el gas fue descubierto en 1773 por Carl Wilhelm Scheele, en Suecia, o en 1774 por Joseph Priestley, en Inglaterra. Se suele pensar que Priestley fue el principal descubridor porque su trabajo se publicó primero (aunque lo llamó "aire desflogístico", y no pensaba que fuera un elemento químico). Antoine Lavoisier dio el nombre de oxygène al gas en 1777. Fue la primera persona que dijo que era un elemento químico. También tenía razón en cuanto a que ayuda a que la combustión funcione.
Primeros experimentos
Uno de los primeros experimentos conocidos sobre cómo la combustión necesita aire fue realizado por el griego Filón de Bizancio en el siglo II a.C. Escribió en su obra Pneumatica que al volcar un recipiente sobre una vela encendida y poner agua alrededor de este recipiente, algo de agua entraba en el recipiente. Filón pensaba que esto se debía a que el aire se convertía en el elemento clásico fuego. Esto es erróneo. Mucho tiempo después, Leonardo da Vinci descubrió que durante la combustión se consumía algo de aire, lo que obligaba a introducir agua en el recipiente.
A finales del siglo XVII, Robert Boyle descubrió que el aire es necesario para la combustión. El químico inglés John Mayow añadió algo más al demostrar que el fuego sólo necesitaba una parte de aire. Ahora lo llamamos oxígeno (O2 ). Descubrió que una vela encendida en un recipiente cerrado hacía que el agua subiera hasta sustituir una catorceava parte del volumen del aire antes de apagarse. Lo mismo ocurrió cuando se introdujo un ratón vivo en la caja. A partir de esto, dedujo que el oxígeno se utiliza tanto para la respiración como para la combustión.
La teoría del flogisto
Robert Hooke, Ole Borch, Mikhail Lomonosov y Pierre Bayen obtuvieron el oxígeno en experimentos realizados en los siglos XVII y XVIII. Ninguno de ellos pensó que fuera un elemento químico. Esto se debió probablemente a la idea de la teoría del flogisto. Esto era lo que la mayoría creía que causaba la combustión y la corrosión.
J. J. Becher propuso la teoría en 1667 y Georg Ernst Stahl la amplió en 1731. La teoría del flogisto afirmaba que todos los materiales combustibles estaban formados por dos partes. Una parte, llamada flogisto, se desprendía cuando se quemaba la sustancia que lo contenía.
Se pensaba que los materiales que dejaban muy pocos residuos al arder, como la madera o el carbón, estaban hechos principalmente de flogisto. Se pensaba que los materiales que se corroen, como el hierro, contenían muy poco. El aire no formaba parte de esta teoría.
Descubrimiento
El alquimista, filósofo y médico polaco Michael Sendivogius escribió sobre algo en el aire que denominó "alimento de la vida", y esto significaba lo que ahora llamamos oxígeno. Sendivogius descubrió, entre 1598 y 1604, que la sustancia del aire es la misma que obtuvo calentando nitrato de potasio. Algunos creen que éste fue el descubrimiento del oxígeno, mientras que otros no están de acuerdo. Algunos dicen que el oxígeno fue descubierto por el farmacéutico sueco Carl Wilhelm Scheele. Obtuvo el oxígeno en 1771 calentando óxido mercúrico y algunos nitratos. Scheele llamó al gas "aire de fuego", porque era el único gas conocido que permitía la combustión (los gases se llamaban "aires" en esa época). Publicó su descubrimiento en 1777.
El 1 de agosto de 1774, el clérigo británico Joseph Priestley enfocó la luz solar sobre el óxido mercúrico en un tubo de vidrio. De este experimento obtuvo un gas al que llamó "aire desflogisticado". Descubrió que las velas ardían con más intensidad en el gas y que un ratón vivía más tiempo mientras lo respiraba. Después de respirar el gas, Priestley dijo que se sentía como el aire normal, pero que sus pulmones se sentían más ligeros y fáciles después. Sus hallazgos se publicaron en 1775. Debido a que sus hallazgos se publicaron primero, a menudo se dice que descubrió el oxígeno.
El químico francés Antoine Lavoisier dijo más tarde que también había descubierto la sustancia. Priestley le visitó en 1774 y le habló de su experimento. Scheele también envió una carta a Lavoisier en ese año en la que hablaba de su descubrimiento.
Las investigaciones de Lavoisier
Lavoisier realizó los primeros experimentos principales sobre la oxidación. Fue la primera persona en explicar cómo funciona la combustión. Utilizó estos y otros experimentos para demostrar que la teoría del flogisto era errónea. También intentó demostrar que la sustancia descubierta por Priestley y Scheele era un elemento químico.
En un experimento, Lavoisier descubrió que no se producía un aumento de peso cuando el estaño y el aire se calentaban en un recipiente cerrado. También descubrió que el aire entraba a toda prisa cuando se abría el recipiente. Después de esto, descubrió que el peso del estaño había aumentado en la misma cantidad que el peso del aire que se precipitaba. Publicó sus hallazgos en 1777. Escribió que el aire estaba formado por dos gases. Uno lo llamó "aire vital" (oxígeno), necesario para la combustión y la respiración. Al otro (nitrógeno) lo llamó "azote", que significa "sin vida" en griego. (Éste sigue siendo el nombre del nitrógeno en algunos idiomas, incluido el francés).
Lavoisier cambió el nombre de "aire vital" por el de "oxygène", de palabras griegas que significan "fabricación de ácido" o "productor de ácido". Lo llamó así porque pensaba que el oxígeno estaba en todos los ácidos, lo cual es erróneo. Los químicos posteriores se dieron cuenta de que el nombre de Lavoiser para el gas era erróneo, pero el nombre era demasiado común para entonces como para cambiarlo.
"Oxígeno" se convirtió en el nombre en lengua inglesa, a pesar de que los científicos ingleses estaban en contra.
Historia posterior
La teoría de los átomos de John Dalton decía que todos los elementos tenían un átomo y que los átomos de los compuestos solían estar solos. Por ejemplo, pensó erróneamente que el agua (H2 O) tenía la fórmula de sólo HO. En 1805, Joseph Louis Gay-Lussac y Alexander von Humboldt demostraron que el agua está formada por dos átomos de hidrógeno y uno de oxígeno. En 1811, Amedeo Avogadro calculó correctamente de qué estaba hecha el agua basándose en la ley de Avogadro.
A finales del siglo XIX, los científicos descubrieron que el aire podía convertirse en un líquido y que los compuestos que contenía podían aislarse comprimiéndolo y enfriándolo. El químico y físico suizo Raoul Pictet descubrió el oxígeno líquido al evaporar el dióxido de azufre para convertir el dióxido de carbono en líquido. A continuación, se evaporó también para enfriar el gas de oxígeno con el fin de convertirlo en líquido. El 22 de diciembre de 1877 envió un telegrama a la Academia de Ciencias francesa comunicando su descubrimiento.

Aire de descomposición de Lavoisier
Características
Propiedades y estructura molecular
A temperatura y presión estándar, el oxígeno no tiene color, olor ni sabor. Es un gas con la fórmula química O
2 llamado dioxígeno.
En el caso del dioxígeno (o simplemente del gas oxígeno), dos átomos de oxígeno están químicamente unidos entre sí. Este enlace puede llamarse de muchas maneras, pero simplemente se denomina doble enlace covalente. El oxígeno gaseoso es muy reactivo y puede reaccionar con muchos otros elementos. Los óxidos se forman cuando los elementos metálicos reaccionan con el oxígeno, como el óxido de hierro, que se conoce como óxido. Hay muchos compuestos de óxido en la Tierra.
Alótropos
El alótropo (tipo) común del oxígeno en la Tierra se llama dioxígeno (O2 ). Es la segunda parte más importante de la atmósfera terrestre, después del dinitrógeno (N2 ). El O2 tiene una longitud de enlace de 121 pm y una energía de enlace de 498 kJ/mol Debido a su energía, el O2 es utilizado por la vida compleja como los animales.
El ozono (O3 ) es muy reactivo y daña los pulmones cuando se respira. El ozono se forma en la atmósfera superior cuando el O2 se combina con el oxígeno puro que se produce cuando el O2 se divide por la radiación ultravioleta. El ozono absorbe mucha radiación en la parte ultravioleta del espectro electromagnético, por lo que la capa de ozono de la atmósfera superior protege a la Tierra de la radiación.
Por encima de la capa de ozono, (en órbitas terrestres bajas), el oxígeno atómico se convierte en la forma más común.
El tetraoxígeno (O4 ) fue descubierto en 2001. Sólo existe en condiciones extremas cuando se ejerce mucha presión sobre el O2 .
Propiedades físicas
El oxígeno se disuelve más fácilmente del aire al agua que el nitrógeno. Cuando hay la misma cantidad de aire y agua, hay una molécula de O2 por cada 2 moléculas de N2 (una proporción de 1:2). Esto es diferente al aire, donde hay una relación de 1:4 entre el oxígeno y el nitrógeno. También es más fácil que el O2 se disuelva en el agua dulce que en el agua de mar. El oxígeno se condensa a 90,20 K (-182,95 °C, -297,31 °F) y se congela a 54,36 K (-218,79 °C, -361,82 °F). Tanto el O líquido como el sólido2 son transparentes y de color azul claro.
El oxígeno es muy reactivo y debe mantenerse alejado de cualquier cosa que pueda arder.
Isótopos
Existen tres isótopos estables de oxígeno en la naturaleza. Son16 O,17 O y18 O. Aproximadamente el 99,7% del oxígeno es el isótopo16 O.
Ocurrencia
El oxígeno es el tercer elemento más común en el universo, después del hidrógeno y el helio. Cerca del 0,9% de la masa del Sol es oxígeno.
| Diez elementos más comunes en la Vía Láctea estimados espectroscópicamente | ||||
| Z | Elemento | Fracción de masa en partes por millón | ||
| 1 | 739,000 | 71 × masa de oxígeno (barra roja) | ||
| 2 | 240,000 | 23 × masa de oxígeno (barra roja) | ||
| 8 | Oxígeno | 10,400 |
| |
| 6 | 4,600 |
| ||
| 10 | Neón | 1,340 |
| |
Aparte del hierro, el oxígeno es el elemento más común de la Tierra (en masa). Constituye casi la mitad (entre el 46% y el 49,2%) de la corteza terrestre como parte de compuestos de óxido, como el dióxido de silicio, y de otros compuestos, como los carbonatos. También es la parte principal de los océanos de la Tierra, constituyendo el 88,8% en masa. El gas oxígeno es la segunda parte más común de la atmósfera, constituyendo el 20,95% de su volumen y el 23,1% de su volumen. La Tierra es extraña en comparación con otros planetas, ya que una gran cantidad de su atmósfera es gas oxígeno. Marte sólo tiene un 0,1% de O
2 en volumen, mientras que los demás planetas tienen menos.
La cantidad mucho mayor de gas oxígeno alrededor de la Tierra se debe al ciclo del oxígeno. La fotosíntesis toma el hidrógeno del agua utilizando la energía de la luz solar. Esto desprende gas oxígeno. Una parte del hidrógeno se combina con el dióxido de carbono para producir hidratos de carbono. A continuación, la respiración extrae el gas oxígeno de la atmósfera o del agua y lo convierte en dióxido de carbono y agua.
Utiliza
Médico
O2 es una parte muy importante de la respiración. Por ello, se utiliza en medicina. Se utiliza para aumentar la cantidad de oxígeno en la sangre de las personas y así poder respirar mejor. Esto puede hacer que se pongan sanos más rápidamente si están enfermos. La oxigenoterapia se utiliza para tratar el enfisema, la neumonía, algunos problemas cardíacos y cualquier enfermedad que dificulte la absorción de oxígeno por parte de una persona.
Soporte vital
El O2 a baja presión se utiliza en los trajes espaciales, rodeando el cuerpo con el gas. Se utiliza oxígeno puro pero a una presión mucho menor. Si la presión fuera mayor, sería venenoso.
Industrial
La fundición del mineral de hierro para convertirlo en acero utiliza aproximadamente el 55% del oxígeno producido por el ser humano. Para ello, se inyecta gas O2 en el mineral a través de una lanza a alta presión. Esto elimina el azufre o el carbono del mineral que no se desea. Se desprenden como óxido de azufre y dióxido de carbono. La temperatura puede llegar hasta los 1.700 °C porque es una reacción exotérmica.
Alrededor del 25% del oxígeno producido por el ser humano es utilizado por los químicos. El etileno se hace reaccionar con O2 para hacer óxido de etileno. Éste se transforma en glicol de etileno, que se utiliza para fabricar muchos productos, como anticongelantes y poliéster (que luego pueden convertirse en plásticos y tejidos).
El otro 20% del oxígeno fabricado por el ser humano se utiliza en medicina, corte y soldadura de metales, combustible para cohetes y tratamiento del agua.

Un concentrador de oxígeno en la casa de un paciente con enfisema
Compuestos
El estado de oxidación del oxígeno es -2 en casi todos los compuestos en los que se encuentra. En unos pocos compuestos, el estado de oxidación es -1, como los peróxidos. Los compuestos de oxígeno con otros estados de oxígeno son muy poco frecuentes.
Óxidos y otros compuestos inorgánicos
El agua (H
2O) es un óxido de hidrógeno. Es el óxido más común en la Tierra. Toda la vida conocida necesita agua para vivir. El agua está formada por dos átomos de hidrógeno unidos covalentemente a un átomo de oxígeno (el oxígeno tiene una electronegatividad mayor que el hidrógeno). (este es el principio básico del enlace covalente) También existen fuerzas electrostáticas (fuerzas de Van de'r Waals) entre los átomos de hidrógeno y los átomos de oxígeno de las moléculas adyacentes. Estos pseudoenlaces hacen que los átomos se acerquen entre sí alrededor de un 15% más que en la mayoría de los otros líquidos simples. Esto se debe a que el agua es una molécula polar (distribución neta asimétrica de los electrones) debido a su forma curvada, lo que le confiere una dirección de campo neta global, debida principalmente a los 2 pares de electrones no enlazantes de los oxígenos, que empujan a los H enlazantes más juntos que la disposición lineal con menor entalpía (véase CO2 ). Esta propiedad es aprovechada por las microondas para hacer oscilar las moléculas polares, especialmente el agua. Y es la responsable de la energía extra necesaria para disociar el H2 0.
Debido a la alta electronegatividad del oxígeno, establece enlaces químicos con casi todos los demás elementos químicos. Estos enlaces dan lugar a óxidos (por ejemplo, el hierro reacciona con el oxígeno para dar óxido de hierro). La mayoría de las superficies de los metales se convierten en óxidos cuando están en el aire. La superficie del hierro se convierte en óxido (óxido de hierro) cuando está en el aire durante mucho tiempo. Hay pequeñas cantidades de dióxido de carbono (CO
2) en el aire, y se convierte en carbohidratos durante la fotosíntesis. Los seres vivos lo desprenden durante la respiración.
Compuestos orgánicos
Muchos compuestos orgánicos tienen oxígeno. Algunas de las clases de compuestos orgánicos que tienen oxígeno son los alcoholes, los éteres, las cetonas, los aldehídos, los ácidos carboxílicos, los ésteres y las amidas. Muchos disolventes orgánicos también tienen oxígeno, como la acetona, el metanol y el isopropanol. El oxígeno también se encuentra en casi todas las biomoléculas que fabrican los seres vivos.
El oxígeno también reacciona rápidamente con muchos compuestos orgánicos a temperatura ambiente, o por debajo de ella, cuando se produce la autoxidación.
Producción industrial
Cien millones de toneladas de O2 se obtienen del aire para usos industriales cada año. Las industrias utilizan dos métodos principales para fabricar oxígeno. El método más común es la destilación fraccionada del aire licuado. El N 2se evapora mientras que el O2 queda en estado líquido. El O2 es el segundo gas industrial más importante. Como es más económico, el oxígeno suele almacenarse y transportarse en forma de líquido. Un pequeño tanque de acero de 16 litros de capacidad de agua con una presión de trabajo de 139 bar (2015 psi) contiene unos 2150 litros de gas y pesa 28 kilogramos (62 lb) vacío. 2150 litros de oxígeno pesan unos 3 kilogramos (6,6 lb).
El otro método principal para fabricar oxígeno consiste en hacer pasar una corriente de aire limpio y seco a través de un par de tamices moleculares de zeolita. Los tamices moleculares de zeolita absorben el nitrógeno. Así se obtiene una corriente de gas que tiene entre un 90% y un 93% de oxígeno.
El gas oxígeno también puede fabricarse mediante la electrólisis del agua en oxígeno molecular e hidrógeno.

El cilindro de la derecha contiene oxígeno líquido.
Seguridad
La norma NFPA 704 del oxígeno dice que el gas oxígeno comprimido no es peligroso para la salud y no es inflamable.
Toxicidad
A altas presiones, el gas oxígeno (O2 ) puede ser peligroso para los animales, incluidos los humanos. Puede provocar convulsiones y otros problemas de salud. La toxicidad del oxígeno suele empezar a producirse a presiones superiores a 50 kilopascales (kPa), lo que equivale a cerca del 50% de oxígeno en el aire a presión estándar (el aire en la Tierra tiene alrededor del 20% de oxígeno).
Los bebés prematuros solían ser colocados en cajas con aire con una alta cantidad de O2 . Esto se dejó de hacer cuando algunos bebés se quedaron ciegos por el oxígeno.
Respirar O puro2 en los trajes espaciales no causa ningún daño porque se utiliza una presión más baja.
Peligros de combustión y otros
Las cantidades concentradas de O puro2 pueden provocar un incendio rápido. Cuando el oxígeno concentrado y los combustibles se acercan, una ligera ignición puede provocar un gran incendio. Los tripulantes del Apolo 1 murieron todos por un incendio porque el aire de la cápsula tenía una cantidad muy elevada de oxígeno.
Si el oxígeno líquido se derrama sobre compuestos orgánicos, como la madera, puede explotar.
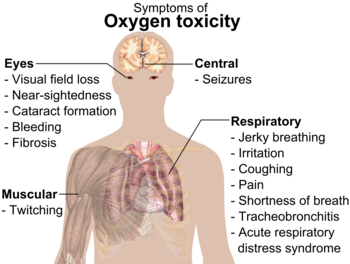
Los síntomas de la intoxicación por oxígeno.
Páginas relacionadas
Preguntas y respuestas
P: ¿Cuál es el símbolo del oxígeno?
R: El símbolo del oxígeno es O.
P: ¿Cuántos átomos de oxígeno se encuentran normalmente en el dioxígeno (O2)?
R: El dioxígeno (O2) suele contener dos átomos de oxígeno.
P: ¿De qué color es el oxígeno líquido o sólido?
R: El oxígeno líquido o sólido es de color azul pálido.
P: ¿A qué grupo de la tabla periódica pertenece el oxígeno?
R: El oxígeno pertenece al grupo de los calcógenos de la tabla periódica.
P: ¿Qué parte de la atmósfera terrestre, en volumen, está formada por oxígeno?
R: El oxígeno constituye más de una quinta parte de la atmósfera terrestre en volumen.
P: ¿Cómo producen las plantas y otros organismos la mayor parte del oxígeno atmosférico de la Tierra?
R: Las plantas y otros organismos producen la mayor parte del oxígeno atmosférico de la Tierra mediante la fotosíntesis, que consiste en utilizar la luz solar para convertir el agua en hidrógeno y liberar oxígeno como subproducto.
P: ¿Qué usos tiene la forma líquida o solidificada del oxígeno?
R: Las formas líquidas o solidificadas deoxígeno pueden utilizarse como propulsores de cohetes, para soldar, con fines médicos y para respirar cuando no se dispone de aire bueno (por ejemplo, buzos y bomberos).
Buscar dentro de la enciclopedia