Átomo | la unidad más básica de la materia
Un átomo es la unidad más básica de la materia. Toda la materia normal en la Tierra y en todo el Universo está hecha de átomos. Esto incluye los sólidos, los líquidos y los gases. Hay un número fijo de tipos diferentes de átomos, llamados elementos químicos. Un átomo es la unidad más pequeña de la materia que puede combinarse con otros átomos para formar moléculas y materia más compleja que tiene cualidades químicas específicas.
Los átomos son muy pequeños, pero su tamaño exacto depende del tipo. Los átomos miden entre 0,1 y 0,5 nanómetros. Un nanómetro es unas 100.000 veces más pequeño que la anchura de un cabello humano. Esto hace que un átomo sea imposible de ver sin herramientas especiales. Los científicos descubren cómo funcionan haciendo experimentos.
Los átomos están formados por tres tipos de partículas subatómicas. Son los protones, los neutrones y los electrones. Los protones y los neutrones son más pesados y se encuentran en el centro del átomo, que se llama núcleo. El núcleo es muy pequeño y denso. Está rodeado por electrones de poco peso. Los electrones son atraídos al núcleo por la fuerza electromagnética porque tienen cargas eléctricas opuestas.
Los átomos con el mismo número de protones son el mismo elemento químico. Tienen propiedades muy similares. Ejemplos de elementos son el hidrógeno y el oro. En el mundo natural existen unos 92 elementos. (Se han fabricado más artificialmente en el laboratorio). Los átomos con el mismo número de protones, pero con diferente número de neutrones, se llaman isótopos. Normalmente, un átomo tiene el mismo número de electrones que de protones. Si un átomo tiene más o menos electrones que protones, se llama ion y tiene carga eléctrica.
Muchas cosas están hechas de más de un tipo de átomo. Se trata de compuestos o mezclas químicas. Los átomos pueden unirse estableciendo enlaces químicos. Un grupo de átomos conectados por enlaces químicos se llama molécula. Por ejemplo, una molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno.
Los átomos sólo se crean, se destruyen o se transforman en otro tipo de átomo en raras ocasiones. Esto sucede si las fuerzas internas son demasiado débiles para mantenerlos unidos. Estos cambios se estudian en la física nuclear. Los átomos también pueden unirse para formar átomos más grandes a temperaturas muy altas, como en el interior de una estrella.
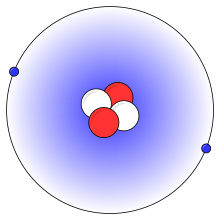
Una imagen simplificada de un átomo de helio, con dos protones (rojo), dos neutrones (blanco) y dos electrones (azul)
Historia
La palabra "átomo" proviene del griego (ἀτόμος) "atomos", indivisible, de (ἀ)-, no, y τόμος, un corte. La primera persona de la que tenemos constancia que utilizó la palabra "átomo" es el filósofo griego Demócrito, hacia el año 400 a.C. Creía que todo estaba hecho de átomos, y que los átomos no podían romperse en trozos más pequeños. La teoría atómica fue inicialmente un tema filosófico, sin mucha investigación o estudio científico real, hasta el desarrollo de la química en la década de 1650.
En 1777 el químico francés Antoine Lavoisier definió por primera vez el término elemento. Dijo que un elemento era cualquier sustancia básica que no podía descomponerse en otras sustancias por los métodos de la química. Cualquier sustancia que pudiera descomponerse era un compuesto.
En 1803, el filósofo inglés John Dalton sugirió que los elementos estaban formados por pequeñas bolas sólidas llamadas átomos. Dalton creía que todos los átomos de un mismo elemento tienen la misma masa. Decía que los compuestos se forman cuando se combinan átomos de más de un elemento. Según Dalton, en un determinado compuesto, los átomos de los elementos del compuesto se combinan siempre de la misma manera.
En 1827, el científico británico Robert Brown observó los granos de polen en el agua bajo su microscopio. Los granos de polen parecían agitarse. Brown utilizó la teoría atómica de Dalton para describir los patrones de su movimiento. Esto se llamó movimiento browniano. En 1905, Albert Einstein utilizó las matemáticas para demostrar que las partículas de polen se movían por el movimiento, o el calor, de las moléculas individuales de agua. Con ello, demostró de forma concluyente la existencia del átomo. En 1869, el científico ruso Dmitri Mendeleev publicó la primera versión de la tabla periódica. La tabla periódica agrupa los elementos por su número atómico (cuántos protones tienen; suele ser el mismo que el número de electrones). Los elementos de una misma columna, o periodo, suelen tener propiedades similares. Por ejemplo, el helio, el neón, el argón, el criptón y el xenón están todos en la misma columna y tienen propiedades muy similares. Todos estos elementos son gases que no tienen color ni olor. Además, son incapaces de combinarse con otros átomos para formar compuestos. Juntos se conocen como los gases nobles.
El físico J.J. Thomson fue la primera persona que descubrió los electrones. Esto ocurrió mientras trabajaba con rayos catódicos en 1897. Se dio cuenta de que tenían una carga negativa y de que el núcleo atómico tenía una carga positiva. Thomson elaboró el modelo del pudín de ciruelas, según el cual un átomo era como un pudín de ciruelas: los frutos secos (electrones) estaban pegados en una masa de pudín (que tenía carga positiva). En 1909, un científico llamado Ernest Rutherford utilizó el experimento Geiger-Marsden para demostrar que la mayor parte de un átomo se encuentra en un espacio muy pequeño, el núcleo atómico. Rutherford tomó una placa fotográfica y la cubrió con una lámina de oro. A continuación, disparó partículas alfa (formadas por dos protones y dos neutrones pegados) contra ella. Muchas de las partículas atravesaron la lámina de oro, lo que demostró que los átomos son en su mayoría espacio vacío. Los electrones son tan pequeños y se mueven tan rápido que no impidieron el paso de las partículas. Más tarde, Rutherford descubrió los protones en el núcleo.
En 1913, Niels Bohr introdujo el modelo de Bohr. Este modelo demostró que los electrones viajan alrededor del núcleo en órbitas circulares fijas. Esto era más preciso que el modelo de Rutherford. Sin embargo, todavía no era completamente correcto. Se han introducido mejoras en el modelo de Bohr después de su introducción.
En 1925, el químico Frederick Soddy descubrió que algunos elementos de la tabla periódica tenían más de un tipo de átomo, llamados isótopos. Soddy creía que los isótopos de un elemento tienen una masa diferente. Para demostrarlo, el químico Francis W. Aston construyó el espectrómetro de masas, que mide la masa de los átomos individuales. Aston demostró que Soddy tenía razón. También descubrió que la masa de cada átomo es un número entero de veces la masa del protón. Esto significaba que debía haber alguna partícula en el núcleo además de los protones. En 1932, el físico James Chadwick disparó partículas alfa a átomos de berilio. Vio que una partícula salía disparada de los átomos de berilio. Esta partícula no tenía carga, pero tenía aproximadamente la misma masa que un protón. Llamó a esta partícula el neutrón.
El modelo más preciso hasta ahora procede de la ecuación de Schrödinger. Schrödinger aprendió que los electrones existen en una nube alrededor del núcleo, llamada nube de electrones. En la nube de electrones, es imposible saber exactamente dónde están los electrones. La ecuación de Schrödinger se utiliza para determinar dónde es probable que esté un electrón. Esta zona se denomina orbital del electrón.
En 1937, el químico alemán Otto Hahn se convirtió en la primera persona en realizar la fisión nuclear en un laboratorio. Lo descubrió por casualidad al disparar neutrones a un átomo de uranio, con la esperanza de fabricar un nuevo isótopo. Sin embargo, observó que en lugar de un nuevo isótopo, el uranio se transformaba en un átomo de bario, un átomo más pequeño que el uranio. Hahn había "roto" el átomo de uranio. Esta fue la primera reacción de fisión nuclear registrada en el mundo. Este descubrimiento condujo finalmente a la creación de la bomba atómica y de la energía nuclear, donde la fisión se produce repetidamente, creando una reacción en cadena.
Más adelante, en el siglo XX, los físicos profundizaron en los misterios del átomo. Utilizando aceleradores de partículas, descubrieron que los protones y los neutrones estaban hechos de otras partículas, llamadas quarks.
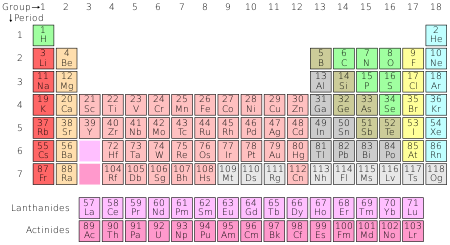
La tabla periódica organiza todos los elementos químicos conocidos.
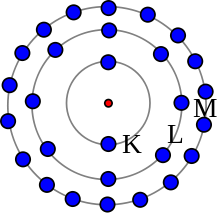
El modelo de Bohr no es exacto, pero es útil para la idea de las capas de electrones. Este átomo tiene 28 electrones en tres envolturas.

Ernest Rutherford
Clasificación
El número de protones de un átomo se llama su número atómico. Los átomos de un mismo elemento tienen el mismo número atómico. Por ejemplo, todos los átomos de carbono tienen seis protones, por lo que el número atómico del carbono es seis. En la actualidad se conocen 118 elementos. Dependiendo de cómo se cuente el número, entre 90 y 94 elementos existen de forma natural en la Tierra. Todos los elementos por encima del número 94 sólo han sido fabricados por el ser humano. Estos elementos están organizados en la tabla periódica.
Como los protones y los neutrones tienen una masa muy similar y la masa de los electrones es muy pequeña, podemos llamar al número de protones y neutrones de un átomo su número de masa. La mayoría de los elementos tienen varios isótopos con números de masa diferentes. Para nombrar un isótopo, utilizamos el nombre del elemento, seguido de su número másico. Así, un átomo con seis protones y siete neutrones se llama carbono-13. La masa media de todos los átomos de un elemento concreto se denomina masa atómica o peso atómico.
Si se cambian los protones, neutrones o electrones de un átomo por otras partículas, se pueden fabricar átomos exóticos. Los experimentos han demostrado que cada partícula tiene un opuesto llamado antipartícula. Juntas, estas partículas constituyen la antimateria. Un átomo de antimateria estaría hecho de antiprotones, antineutrones y antielectrones (positrones). Cuando una partícula se encuentra con su antipartícula, ambas se destruyen. Aparte de eso, los átomos de antimateria podrían ser muy parecidos a los átomos normales.
Estructura y partes
Piezas
Un átomo está formado por tres partículas principales: el protón, el neutrón y el electrón. El hidrógeno-1, un isótopo del hidrógeno, no tiene neutrones, sólo un protón y un electrón. Un ión de hidrógeno positivo no tiene electrones, sólo un protón. Todos los demás átomos tienen al menos un protón, un neutrón y un electrón cada uno.
Los electrones son, con mucho, la más pequeña de las tres partículas atómicas. Su tamaño es demasiado pequeño para ser medido con la tecnología actual, y su masa es de unos 9,1×10−28 gramos (0,00055 unidades de masa atómica). Tienen una carga negativa. Los protones y los neutrones tienen un tamaño y un peso similares entre sí, con una masa de aproximadamente 1,7×10−24 gramos (1 unidad de masa atómica). Los protones tienen una carga positiva y los neutrones no tienen carga. La mayoría de los átomos tienen una carga neutra. El número de protones (positivos) y de electrones (negativos) es el mismo, por lo que las cargas se equilibran a cero. Sin embargo, en los iones (con diferente número de electrones), esto no es así, y pueden tener una carga positiva o negativa. Los protones y los neutrones están formados por quarks de dos tipos: quarks up y quarks down. Un protón está formado por dos quarks up y un quark down, y un neutrón está formado por dos quarks down y un quark up.
Núcleo
El núcleo está en el centro de un átomo. Constituye más del 99,9% de la masa del átomo. Sin embargo, es muy pequeño: aproximadamente 1 femtómetro (10−15 m) de diámetro, lo que es unas 100.000 veces menor que la anchura de un átomo, por lo que tiene una densidad muy alta. Está formado por protones y neutrones. Normalmente, en la naturaleza, dos cosas con la misma carga se repelen o se alejan la una de la otra. Por eso, durante mucho tiempo, los científicos no sabían cómo los protones con carga positiva del núcleo se mantenían unidos. Ahora creemos que la atracción entre protones y neutrones proviene de la interacción fuerte.
La interacción fuerte es más fuerte en una distancia muy corta. A esta distancia, es transportada por una partícula llamada gluón. Los gluones actúan como un pegamento para unir los quarks dentro de un protón o un neutrón. A una distancia mayor, la interacción fuerte es más débil. La transporta una partícula llamada mesón. Los mesones atraen a los protones y neutrones mediante la interacción fuerte. Mantienen el núcleo unido. Esta forma especial de la interacción fuerte se llama fuerza nuclear.
El número de neutrones en relación con los protones define si el núcleo es estable o sufre una desintegración radiactiva. Cuando hay demasiados neutrones o protones, el átomo intenta reducir o igualar los números eliminando las partículas sobrantes. Lo hace emitiendo radiación en forma de desintegración alfa, beta o gamma. Los núcleos también pueden cambiar por otros medios. La fisión nuclear se produce cuando el núcleo se rompe en dos núcleos más pequeños, liberando mucha energía. Esta liberación de energía es lo que hace que la fisión nuclear sea útil para fabricar bombas y electricidad en forma de energía nuclear. La otra forma en que los núcleos pueden cambiar es a través de la fusión nuclear, cuando dos núcleos se unen o fusionan para formar un núcleo más grande. Este proceso requiere cantidades extremas de energía para superar la repulsión electrostática entre los protones, ya que tienen la misma carga. Estas energías tan elevadas son más comunes en estrellas como nuestro Sol, que fusiona hidrógeno para obtener combustible. Sin embargo, una vez que se produce la fusión, se libera mucha más energía debido a la conversión de parte de la masa en energía.
Electrones
Los electrones orbitan, o viajan, alrededor del núcleo. Se les llama la nube de electrones del átomo. Son atraídos por el núcleo debido a la fuerza electromagnética. Los electrones tienen una carga negativa y el núcleo siempre tiene una carga positiva, por lo que se atraen mutuamente.
Según el modelo de Bohr, algunos electrones están más lejos del núcleo que otros en diferentes capas. Éstas se denominan capas de electrones. Hemos aprendido que sólo los electrones de la capa exterior pueden establecer enlaces químicos. El número de electrones de la capa exterior determina si el átomo es estable o con qué átomos se enlazará en una reacción química. Si un átomo sólo tiene una capa, necesita dos electrones para estar completo. En caso contrario, la capa exterior necesita ocho electrones para estar completa.
El modelo de Bohr es importante porque tiene la idea de los niveles de energía. Los electrones de cada cáscara tienen una cantidad específica de energía. Las cáscaras que están más alejadas del núcleo tienen más energía. Cuando una pequeña ráfaga de energía llamada fotón golpea un electrón, éste puede saltar a una cáscara de mayor energía. Este fotón debe llevar exactamente la cantidad de energía adecuada para llevar al electrón al nuevo nivel de energía. Un fotón es una ráfaga de luz, y la cantidad de energía determina el color de la luz. Así, cada tipo de átomo absorberá determinados colores de luz, lo que se denomina espectro de absorción. Un electrón también puede enviar, o emitir, un fotón, y caer en una capa de energía más baja. Por razones similares, el átomo sólo enviará ciertos colores de luz, lo que se denomina espectro de emisión.
El panorama completo es más complicado. A diferencia de la Tierra que se mueve alrededor del Sol, los electrones no se mueven en círculo. No podemos conocer el lugar exacto de un electrón. Sólo conocemos la probabilidad, o el azar, de que se encuentre en cualquier lugar. Cada electrón forma parte de un orbital, que describe dónde es probable que esté. No puede haber más de dos electrones en un orbital; estos dos electrones tienen diferente espín.
Para cada cáscara, numerada como 1, 2, 3, y así sucesivamente, puede haber varios orbitales con diferentes formas. Los tipos de orbitales reciben letras: s, p, d y f. También puede haber varios orbitales para una combinación de número y letra. A medida que se añaden más electrones, éstos se unen a los orbitales en orden de menor a mayor energía. Este orden comienza de la siguiente manera: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d. Por ejemplo, un átomo de cloro tiene 17 electrones. Por tanto, tendrá 2 electrones en el orbital 1s, 2 electrones en el orbital 2s, 6 electrones en los orbitales 2p, 2 electrones en el orbital 3s y 5 electrones en los orbitales 3p. En otras palabras, tiene 2 electrones en la primera capa, 8 en la segunda y 7 en la tercera.

Formas de los diferentes orbitales alrededor de un átomo
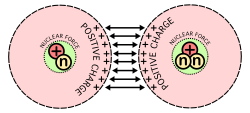
Una imagen que muestra la principal dificultad de la fusión nuclear: Los protones, que tienen cargas positivas, se repelen cuando son forzados a juntarse.
Propiedades
Tamaño y masa
El tamaño de un átomo depende del tamaño de su nube de electrones. Al descender en la tabla periódica, se añaden más capas de electrones. Como resultado, los átomos se hacen más grandes. Al desplazarse hacia la derecha en la tabla periódica, se añaden más protones al núcleo. Sin embargo, no se añaden envolturas de electrones. Este núcleo más positivo atrae con más fuerza a los electrones, por lo que los átomos se hacen más pequeños. El átomo más grande es el cesio, que mide unos 0,596 nanómetros según un modelo. El átomo más pequeño es el helio, que tiene unos 0,062 nanómetros de ancho.
La masa de los átomos oscila entre 1,7×10−24 y 4,9×10 −22gramos. Normalmente, la masa se mide con la unidad de masa atómica (amu), también llamada daltón. Un amu es exactamente 1/12 de la masa de un átomo de carbono-12, que es de 1,7×10−24 gramos. El hidrógeno-1 tiene una masa de aproximadamente 1 amu, y el átomo más pesado conocido, el oganesson, tiene una masa de aproximadamente 294 amu.
Cómo interactúan los átomos
Cuando los átomos están muy separados, se atraen entre sí. Esta atracción es más fuerte para algunos tipos de átomos que para otros. Al mismo tiempo, el calor, o la energía cinética, de los átomos hace que se muevan constantemente. Si la atracción es lo suficientemente fuerte, en relación con la cantidad de calor, los átomos formarán un sólido. Si la atracción es más débil, formarán un líquido, y si es más débil aún, formarán un gas.
Los enlaces químicos son los tipos de atracción más fuertes entre los átomos. Todos los enlaces químicos implican el movimiento de electrones. Los átomos suelen enlazarse entre sí de forma que llenan o vacían su capa exterior de electrones. Los elementos más reactivos necesitan perder o ganar un pequeño número de electrones para tener una capa exterior completa. Los átomos con una capa exterior completa, llamados gases nobles, no suelen formar enlaces.
Hay tres tipos principales de enlaces: enlaces iónicos, enlaces covalentes y enlaces metálicos.
- En un enlace iónico, un átomo cede electrones a otro átomo. Cada átomo se convierte en un ion: un átomo o grupo de átomos con carga positiva o negativa. El ion positivo (que ha perdido electrones) se llama catión; suele ser un metal. El ion negativo (que ha ganado electrones) se llama anión; suele ser un no metal. El enlace iónico suele dar lugar a una red, o cristal, de iones unidos.
- En un enlace covalente, dos átomos comparten electrones. Esto suele ocurrir cuando ambos átomos son no metales. Los enlaces covalentes suelen formar moléculas, cuyo tamaño oscila entre dos átomos y muchos más. También pueden formar grandes redes, como el vidrio o el grafito. El número de enlaces que realiza un átomo (su valencia) suele ser el número de electrones necesarios para llenar su capa externa de electrones.
- En un enlace metálico, los electrones viajan libremente entre muchos átomos del metal. Cualquier número de átomos puede unirse de esta manera. Los metales conducen la corriente eléctrica porque la carga eléctrica puede fluir fácilmente a través de ellos. Los átomos de los metales pueden pasar unos junto a otros, por lo que es fácil doblar, estirar y remodelar los metales.
Todos los átomos se atraen entre sí mediante fuerzas de Van der Waals, que son más débiles que los enlaces químicos. Estas fuerzas se producen cuando los electrones se mueven hacia un lado de un átomo. Este movimiento da una carga negativa a ese lado. También da una carga positiva al otro lado. Cuando dos átomos alinean sus lados con carga negativa y positiva, se atraerán.
A pesar de ser un espacio mayoritariamente vacío, los átomos no pueden atravesarse unos a otros. Cuando dos átomos están muy cerca, sus nubes de electrones se repelen por la fuerza electromagnética.
Magnetismo
Un electrón tiene una propiedad llamada momento magnético, que tiene una dirección y una magnitud (o tamaño). El momento magnético procede del espín individual del electrón y de su órbita alrededor del núcleo. Juntos, los momentos magnéticos de los electrones suman un momento magnético para todo el átomo. Esto explica el comportamiento de los átomos en un campo magnético.
Cada electrón de un átomo tiene uno de los dos tipos de espín. Si cada electrón se empareja con un electrón con el espín opuesto, los espines se cancelarán, por lo que el átomo no tendrá un momento magnético duradero. Los átomos así se llaman diamagnéticos: sólo se repelen débilmente por un campo magnético.
Sin embargo, si algunos electrones no están emparejados, el átomo tendrá un momento magnético duradero: será paramagnético o ferromagnético. Cuando los átomos son paramagnéticos, el momento magnético de cada átomo apunta en una dirección aleatoria. Son atraídos débilmente por un campo magnético. Cuando los átomos son ferromagnéticos, los momentos magnéticos de los átomos cercanos actúan entre sí. Apuntan en la misma dirección. En un campo magnético, la mayoría de los átomos se alinearán en la dirección del campo. Los materiales ferromagnéticos, como el hierro, el cobalto y el níquel, son fuertemente atraídos por un campo magnético.
Descomposición radiactiva
Algunos elementos, y muchos isótopos, tienen lo que se llama un núcleo inestable. Esto significa que el núcleo es demasiado grande para mantenerse unido o tiene demasiados protones o neutrones. Cuando esto ocurre, el núcleo tiene que eliminar el exceso de masa de partículas. Lo hace a través de la radiación. Un átomo que hace esto puede llamarse radiactivo. Los átomos inestables emiten radiación hasta que pierden suficientes partículas en el núcleo para volverse estables. Todos los átomos por encima del número atómico 82 (82 protones, el plomo) son radiactivos.
Hay tres tipos principales de desintegración radiactiva: alfa, beta y gamma.
- La desintegración alfa se produce cuando el átomo emite una partícula con dos protones y dos neutrones. Se trata esencialmente de un núcleo de helio. El resultado es un elemento con un número atómico dos menos que antes. Así, por ejemplo, si un átomo de berilio (número atómico 4) sufriera una desintegración alfa, se convertiría en helio (número atómico 2). La desintegración alfa se produce cuando un átomo es demasiado grande y necesita deshacerse de algo de masa.
- La desintegración beta se produce cuando un neutrón se convierte en un protón, o un protón se convierte en un neutrón. En el primer caso, el átomo expulsa un electrón. En el segundo caso, es un positrón (como un electrón pero con carga positiva). El resultado es un elemento con un número atómico superior o inferior al anterior. La desintegración beta se produce cuando un átomo tiene demasiados protones o demasiados neutrones.
- La desintegración gamma se produce cuando un átomo emite un rayo gamma, o una onda. Se produce cuando hay un cambio en la energía del núcleo. Suele ocurrir después de que un núcleo haya pasado por una desintegración alfa o beta. No hay ningún cambio en la masa del átomo, ni en el número atómico, sólo en la energía almacenada dentro del núcleo, en forma de espín de la partícula.
Cada elemento o isótopo radiactivo tiene una vida media. Es el tiempo que tarda la mitad de cualquier muestra de átomos de ese tipo en decaer hasta convertirse en un isótopo o elemento diferente.
Fisión y fusión
Los dispositivos que utilizan la fisión nuclear comienzan disparando neutrones a los átomos. Esto hace que el átomo se rompa rápidamente. La fisión de un átomo dispara más neutrones, que luego rompen otros átomos, creando reacciones en cadena. Este proceso produce enormes cantidades de energía térmica. La reacción en cadena de la fisión alimentó las primeras armas nucleares (bombas de fisión). Las centrales nucleares son un poco diferentes: se utilizan unas cosas llamadas barras de control para ralentizar la fisión. Las barras de control recogen parte de los neutrones, lo que impide que se produzca una reacción en cadena.
La fusión nuclear se produce sobre todo en el Sol y en otras estrellas. Requiere un lugar caliente pero produce más energía que la fisión. Esto explica el calor y la luz del Sol. El Sol fusiona ahora el hidrógeno en helio, mientras que las estrellas más grandes y calientes fabrican átomos más pesados. Las bombas de fusión, o armas termonucleares, son las armas nucleares más potentes. Los científicos intentan fabricar reactores de fusión para centrales nucleares, pero todavía no existe ninguno.
La fusión nuclear y la fisión nuclear producen energía por razones similares. Según la famosa fórmula de Einstein E = mc2 , una pequeña cantidad de masa puede transformarse en una gran cantidad de energía. Cuando los protones y los neutrones se unen en la fusión nuclear, pierden algo de masa, que envían como energía. El núcleo puede dividirse en sus protones y neutrones sólo si se añade la misma cantidad de energía. Esta propiedad de cada tipo de núcleo se llama su energía de enlace nuclear. La fusión o la fisión envían energía si la energía de enlace total aumenta. Los núcleos del rango del hierro-56 y el níquel-62 tienen la mayor energía de enlace dividida por su número de protones y neutrones, por lo que generalmente no pasan por la fisión o la fusión. Los átomos más grandes, como el uranio, pasan por la fisión nuclear, porque aumenta su energía de enlace.
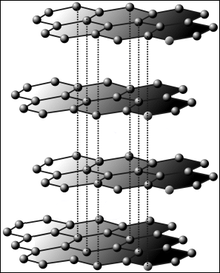
El grafito está formado por átomos de carbono en capas. Cada capa se mantiene unida por enlaces covalentes. La atracción entre las diferentes capas es una fuerza de Van der Waals.
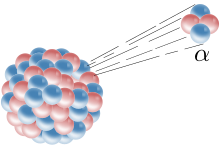
Una partícula alfa sale disparada de un núcleo.
Formación y ocurrencia
Casi todos los átomos de hidrógeno del Universo, la mayoría de los átomos de helio y algunos de los átomos de litio se formaron poco después del Big Bang. Incluso hoy, cerca del 90% de todos los átomos del Universo son de hidrógeno. Los átomos más grandes se fabrican en las estrellas por fusión nuclear, mientras que los más grandes se fabrican en estrellas muy masivas o supernovas. La mayoría de los átomos de la Tierra se formaron en una estrella que existía antes que el Sol.
Se fabrican átomos muy grandes aplastando átomos más pequeños en aceleradores de partículas. Sin embargo, estos átomos suelen decaer muy rápidamente. El oganesson (elemento 118) tiene una vida media de 0,89 milisegundos. Es posible que en el futuro se creen átomos aún más grandes.
Páginas relacionadas
- Física atómica, para más detalles sobre la física de los átomos
- La química, el campo que estudia todas las cosas que están hechas de átomos
- Partícula elemental, las partículas que componen los átomos y todo lo demás
- La mecánica cuántica, el estudio de las pequeñas partículas y cómo interactúan con la energía
- Estados de la materia, las diferentes formas en las que se pueden encontrar los átomos o las moléculas
Preguntas y respuestas
P: ¿Qué es un átomo?
R: Un átomo es la unidad más básica de la materia. Es la unidad más pequeña de la materia que puede combinarse con otros átomos para formar moléculas y materias más complejas que tienen cualidades químicas específicas.
P: ¿Qué tamaño tienen los átomos?
R: Los átomos son muy pequeños, tienen entre 0,1 y 0,5 nanómetros de diámetro, lo que es unas 100.000 veces menor que la anchura de un cabello humano.
P: ¿Cuáles son los tres tipos de partículas subatómicas que componen un átomo?
R: Los tres tipos de partículas subatómicas que componen un átomo son los protones, los neutrones y los electrones. Los protones y los neutrones son más pesados y se encuentran en el núcleo, mientras que los electrones son más ligeros y son atraídos al núcleo por la fuerza electromagnética debido a sus cargas eléctricas opuestas.
P: ¿Cuántos elementos se dan de forma natural en el mundo?
R: Unos 92 elementos se dan de forma natural en el mundo.
P: ¿Qué ocurre cuando un átomo tiene más o menos electrones que protones?
R: Si un átomo tiene más o menos electrones que protones se llama ion y tiene carga eléctrica.
P: ¿Qué tipo de cambios se producen si las fuerzas dentro de los átomos se vuelven demasiado débiles para mantenerlos unidos?
R: Si las fuerzas en el interior de los átomos se vuelven demasiado débiles para mantenerlos unidos, pueden transformarse en otro tipo de átomo o destruirse por completo; este proceso se estudia en la física nuclear.
Buscar dentro de la enciclopedia