Isótopo
Los átomos de un elemento químico pueden existir en diferentes tipos que tienen un comportamiento muy similar, pero que pesan cantidades diferentes. Estos se llaman isótopos del elemento. Los átomos de un mismo elemento tienen el mismo número de protones, pero los diferentes isótopos tienen diferente número de neutrones. Los diferentes isótopos del mismo elemento tienen masas diferentes porque tienen un número diferente de neutrones. La masa es la palabra que designa la cantidad de sustancia (o materia) que tiene algo. Las cosas con masas diferentes también tienen pesos diferentes.
Algunos isótopos no son estables, por lo que cambian a otro isótopo o elemento por desintegración radiactiva. Estos se llaman isótopos radiactivos. Otros no son radiactivos. Se denominan isótopos estables.
Los átomos de un mismo elemento tienen el mismo número de protones, lo que se denomina número atómico. Los diferentes isótopos de un elemento tienen diferentes números de neutrones. En consecuencia, también tienen números de masa diferentes, que es el número de protones más el número de neutrones. Un isótopo suele nombrarse indicando el elemento y el número de masa. Por ejemplo, el símbolo del carbono es C y todos los átomos de carbono tienen 6 protones. El isótopo más común del carbono también tiene 6 neutrones, lo que da un número de masa de 12, y se escribe carbono-12 o12 C. El isótopo del carbono que tiene 8 neutrones se escribe carbono-14 o14 C.
La palabra "isótopo", que significa "en el mismo lugar", proviene del hecho de que los isótopos del mismo elemento se encuentran en el mismo lugar de la tabla periódica.
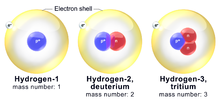
Isótopos del hidrógeno
Propiedades químicas
En cualquier átomo neutro, el número de electrones es el mismo que el de protones. En consecuencia, los isótopos de un mismo elemento también tienen el mismo número de electrones y la misma estructura electrónica. La forma de actuar de un átomo se decide por su estructura electrónica, por lo que los isótopos del mismo elemento tienen casi el mismo comportamiento químico, como las moléculas que pueden formar. Es muy difícil separar los isótopos de un elemento de una mezcla de diferentes isótopos debido a lo similar que es este comportamiento.
Los isótopos más pesados reaccionan químicamente más lentamente que los isótopos más ligeros del mismo elemento. Este "efecto de masa" es grande para el protio (1 H) y el deuterio (2 H), porque el deuterio tiene el doble de masa que el protio. Para los elementos más pesados, la relación de peso atómico relativa entre los isótopos es mucho menor, por lo que el efecto de masa suele ser pequeño.
Estabilidad
Algunos isótopos no son estables, por lo que cambian a un isótopo o elemento diferente por desintegración radiactiva. Estos se denominan isótopos inestables o isótopos radiactivos. El tiempo medio que tarda un isótopo en desintegrarse se llama vida media. Otros isótopos no decaen, por lo que no son radiactivos. Se llaman isótopos estables.
Cada átomo tiene un núcleo atómico, que está formado por protones y neutrones que se mantienen unidos por la fuerza nuclear. Como los protones tienen carga eléctrica positiva, se repelen entre sí. Los neutrones son neutros y estabilizan el núcleo. Los neutrones mantienen los protones ligeramente separados. Esto reduce la repulsión electrostática entre los protones, por lo que la fuerza nuclear puede mantener unidos los protones y los neutrones. Se necesitan uno o más neutrones para que dos o más protones se unan en un núcleo. A medida que el número de protones aumenta, también lo hace el número de neutrones necesarios para tener un núcleo estable.
Algunos elementos sólo tienen un único isótopo que es estable. Por ejemplo, el flúor-19 (19 F) es el único isótopo estable del flúor. Los otros isótopos del flúor se descomponen rápidamente, por lo que no se encuentran en la naturaleza. Otros elementos tienen muchos isótopos estables. Por ejemplo, el xenón tiene siete isótopos estables. También tiene dos isótopos que decaen muy lentamente y que se encuentran en la naturaleza. El mayor número de isótopos estables para cualquier elemento es diez, para el elemento estaño. Algunos elementos no tienen ningún isótopo estable, como el curio. Éstos sólo existen en la Tierra porque se crean en reactores nucleares, explosiones nucleares o aceleradores de partículas.
Algunos isótopos inestables existen de forma natural en la Tierra porque tienen una vida media muy larga. Por ejemplo, el uranio-238 tiene una vida media de 4468 millones de años. La vida media del radio-226 es de sólo 1600 años, y se encuentra en la naturaleza porque se forma constantemente a partir de la desintegración del uranio-238.
El hidrógeno tiene tres isótopos comunes. El isótopo más común del hidrógeno se llama protio (1 H), que tiene un protón y ningún neutrón. El átomo de hidrógeno que tiene un protón y un neutrón (masa atómica de 2) se llama deuterio (2 H). El hidrógeno con un protón y dos neutrones (masa atómica de 3) se llama tritio (3 H). El protio y el deuterio son isótopos estables, mientras que el tritio es un isótopo radiactivo.
Los elementos más pesados de la tabla periódica son todos radiactivos. Todos los isótopos del radón, el torio y el uranio son radiactivos, ya que son muy pesados. Esto se debe a que las fuerzas nucleares dentro del núcleo del átomo no pueden mantener unidos todos los protones y neutrones.
Páginas relacionadas
- Electroquímica isotópica
- Radionúclidos
Preguntas y respuestas
P: ¿Qué son los isótopos?
R: Los isótopos son diferentes tipos de átomos de un elemento químico que tienen un comportamiento muy similar, pero que pesan cantidades diferentes.
P: ¿En qué se diferencian los isótopos entre sí?
R: Los átomos de un mismo elemento tienen el mismo número de protones, pero los distintos isótopos tienen diferente número de neutrones. En consecuencia, también tienen números de masa diferentes, que es el número de protones más el número de neutrones.
P: ¿Son estables todos los isótopos?
R: No, algunos isótopos no son estables, por lo que se transforman en otro isótopo o elemento por desintegración radiactiva. Estos se denominan isótopos radiactivos mientras que otros que no son radiactivos se llaman isótopos estables.
P: ¿Cómo se puede identificar un isótopo?
R: Un isótopo suele nombrarse dando el elemento y su número de masa. Por ejemplo, el carbono-12 o 12C es un átomo con 6 protones y 6 neutrones mientras que el carbono-14 o 14C tiene en cambio 8 neutrones.
P: ¿Qué significa "isótopo"?
R: La palabra "isótopo" significa "en el mismo lugar", refiriéndose a que todos los átomos del mismo elemento aparecen en el mismo lugar de la tabla periódica.
P: ¿Por qué los átomos con más neutrones pesan más que los que tienen menos neutrones?
R: Los átomos con más neutrones pesan más porque contienen partículas adicionales (neutrones) que se suman a su masa total en comparación con los que tienen menos neutrones.
Buscar dentro de la enciclopedia