Tabla periódica de los elementos: definición, estructura y grupos
Guía clara de la tabla periódica: definición, estructura y grupos. Aprende distribución, periodos, familias (metales, metaloides, no metales) y patrones clave para estudiar los elementos.
La tabla periódica de los elementos químicos es una representación ordenada de los elementos químicos conocidos, colocados según su número atómico creciente, que corresponde al número de protones en el núcleo de cada átomo. Esta organización revela patrones periódicos en las propiedades físicas y químicas de los elementos y permite predecir comportamientos y relaciones entre ellos.
Estructura: períodos, grupos y bloques
La tabla se organiza en filas horizontales llamadas períodos y columnas verticales llamadas grupos. Cada período corresponde al llenado de una capa electrónica principal:
- Períodos: existen actualmente siete períodos completos (1 a 7). El periodo 1 tiene 2 elementos (el hidrógeno y el helio), los períodos 2 y 3 contienen 8 elementos cada uno, los períodos 4 y 5 contienen 18 elementos, y los períodos 6 y 7 contienen 32 elementos (incluyendo las series de lantánidos y actínidos). En algunas presentaciones se muestra un hipotético octavo período para elementos superpesados que aún no están confirmados experimentalmente.
- Grupos: la tabla periódica estándar tiene 18 grupos numerados del 1 al 18. Los elementos de un mismo grupo tienen configuraciones electrónicas externas similares (misma cantidad de electrones de valencia) y, por tanto, propiedades químicas parecidas. Por ejemplo, el grupo 18 corresponde a los gases nobles, que en líneas generales son poco reactivos y tienden a existir como gases monoatómicos en condiciones normales.
- Bloques s, p, d y f: la tabla también puede dividirse en bloques según el tipo de orbital que se está llenando (s, p, d, f). Esta clasificación explica muchas de las propiedades periódicas y la aparición de las series de lantánidos y actínidos.
Tendencias periódicas y propiedades
La posición de un elemento en la tabla permite inferir varias tendencias:
- Radio atómico: aumenta al bajar en un grupo y disminuye al avanzar de izquierda a derecha en un período (con excepciones por efectos de apantallamiento y carga nuclear efectiva).
- Electronegatividad e energía de ionización: suelen aumentar hacia la derecha y hacia arriba de la tabla; por eso los elementos en la parte superior derecha son más electronegativos y menos metálicos.
- Carácter metálico: aumenta hacia la izquierda y hacia abajo. Por ejemplo, el cesio es mucho más metálico que el helio.
- Reactividad: los metales alcalinos (grupo 1) son muy reactivos con el agua, mientras que los halógenos (grupo 17) son reactivos con metales y forman haluros. Los gases nobles son en general poco reactivos, aunque los más pesados como el xenón pueden formar compuestos en condiciones adecuadas.
Clasificación por grandes grupos
En términos generales, los elementos se agrupan en:
- Metales: buenos conductores de calor y electricidad, maleables y dúctiles; se encuentran mayoritariamente a la izquierda y en el centro de la tabla.
- Metaloides: tienen propiedades intermedias entre metales y no metales y se sitúan a lo largo de una “escalera” diagonal entre ambos.
- No metales: incluyen gases, halógenos y otros elementos con alta electronegatividad situados en la parte superior derecha.
Usos y utilidad
La tabla periódica es una herramienta fundamental en química, física, ingeniería y otras ciencias. Permite:
- Predecir la reactividad y las posibles combinaciones entre elementos.
- Determinar estructuras electrónicas y estados de oxidación probables.
- Clasificar materiales y diseñar procesos industriales (aleaciones, catalizadores, semiconductores, medicamentos, etc.).
- Guiar la búsqueda y síntesis de nuevos elementos y compuestos.
Historia y evolución
El desarrollo de la tabla periódica culminó con la obra del químico ruso Dmitry IvanovichMendeleyev (1834-1907), quien propuso una tabla basada en las propiedades químicas y los pesos atómicos y predijo la existencia y propiedades de elementos aún no descubiertos, dejando espacios vacíos para ellos. En reconocimiento, el elemento 101 fue nombrado mendelevium.
La formulación moderna de la ley periódica se basa en el número atómico y no en la masa atómica; la Unión Internacional de Química Pura y Aplicada (IUPAC) estandarizó en 1990 la numeración de grupos usando números arábigos (1–18) para evitar ambigüedades entre sistemas anteriores que usaban números romanos.
Elementos sintéticos y superpesados
Además de los elementos naturales, existen elementos sintéticos creados en laboratorios mediante reacciones nucleares. Muchos de ellos (los elementos transuránicos, con número atómico mayor que 92) son inestables y tienen períodos de semidesintegración muy cortos. La tabla sigue ampliándose a medida que se descubren y confirman nuevos elementos: la IUPAC supervisa la asignación de nombres oficiales y símbolos.
En resumen, la tabla periódica es más que una lista: es una herramienta predictiva y conceptual que organiza el conocimiento sobre la materia a escala atómica, revelando patrones que conectan la estructura electrónica con las propiedades químicas y físicas de los elementos.
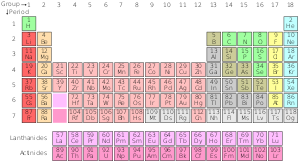
La variación estándar de la tabla periódica
Tabla periódica estándar
| Grupo→ | 10 | 12 | 14 | 15 | 16 | 17 | ||||||||||||||
| 1 | 2 | |||||||||||||||||||
| 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |||||||||||||
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | |||
| 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | |||
| 55 | 56 | * Lantánidos | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | |||
| 87 Fr | 88 | ** Actínidos | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | |||
| 119 Uue | 120 Ubn | *** Superactínidos | ||||||||||||||||||
| * Serie de lantánidos | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | |||||
| ** Serie de Actínidos | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | |||||
| *** Serie de Superactínidos | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129Ube | 130Utn | 131Utu | 132Utb | 133Utt | 134Utq | 135Utp | |||||
| *** Serie de Superactínidos | 136Uth | 137Uts | 138Uto | 139Ute | 140Uqn | 141Uqu | 142Uqb | 143Uqt | 144Uqq | 145Uqp | 146Uqh | 147Uqs | 148Uqo | 149Uqe | 150Upn | |||||
| *** Serie de Superactínidos | 151Upu | 152Upb | 153Upt | 154Upq | 155Upp | 156Uph | 157Ups | 158Upo | 159Upe | 160Uhn | 161Uhu | 162Uhb | 163Uht | 164Uhq | 165Uhp | |||||
| *** Serie de Superactínidos | 166Uhh | 167Uhs | 168Uho | 169Uhe | 170Usn | 171Usu | 172Usb | 173Ust | 174Usq | 175Usp | 176Ush | 177Uss | 178Uso | 179Uso | 180Uon | |||||
| *** Serie de Superactínidos | 181Usted | 182Uob | 183Uot | 184Uoq | 185Uop | 186Uoh | 187Uos | 188Uoo | 189Uoe | 190Uen | 191Ueu | 192Ueb | 193Uet | 194Ueq | 195Uep | |||||
| *** Serie de Superactínidos | 196Ueh | 197Ues | 198Ueo | 199Uee | 200Bnn | 201Bnu | 202Bnb | 203Bnt | 204Bnq | 205Bnp | 206Bnh | 207Bns | 208Bno | 209Bne | 210Bun | |||||
| *** Serie de Superactínidos | 211Buu | 212Bub | 213Pero | 214Buq | 215Bup | 216Buh | 217Bus | 218Buo | 219Bue | 220.000 millones de euros | 221Bbu | 222Bbb | 223Bbt | 224Bbq | 225Bp | |||||
Series químicas de la tabla periódica
- Metales alcalinos
- Tierras alcalinas
- Lantánidos
- Actínidos
- Superactínidos
- Metales de transición
- Metales pobres
- No metales
- Halógenos
Estado a temperatura y presión estándar. El color del número (número atómico) sobre el símbolo del elemento muestra el estado del elemento en condiciones normales.
- los de color azul son gases
- los de color verde son líquidos
- los de color negro son sólidos
- Los que tienen bordes sólidos tienen isótopos estables (elementos primordiales)
- Los que tienen bordes discontinuos sólo tienen isótopos radiactivos de origen natural
- Los que tienen bordes punteados no se dan de forma natural (elementos sintéticos)
- los que no tienen fronteras son demasiado radiactivos para haber sido descubiertos todavía.
Otros métodos de visualización de los elementos químicos
La versión de la tabla periódica que se muestra arriba es la más utilizada. A continuación se muestran otras versiones muy extendidas:
· 
Theodor Benfey dispuso los elementos en espiral, alrededor del hidrógeno. El peso atómico determina la posición del elemento.
· 
Dmitri Ivanovich Mendeleyev utilizó una disposición en forma de flor; los actínidos y lantánidos se muestran como bucles junto al grupo principal.
· 
Timothy Stove ordenó los elementos por número cuántico.
· ![]()
Betterman ordenó los elementos por sus propiedades isoeléctricas, que pueden convertirse en una forma polinómica.
· 
Versión triangular, de Zmaczynski y Bayley
· 
Dispuesto en una pirámide.
Versiones menos utilizadas
- La tabla estándar proporciona lo básico. Se muestra arriba
- Una tabla vertical para mejorar la legibilidad en los navegadores web
- La tabla grande proporciona lo básico y los nombres completos de los elementos
- La enorme tabla proporciona los datos básicos, además de los nombres completos de los elementos y las masas atómicas
- Configuraciones de electrones
- Metales y no metales
- Lista de elementos: incluye el nombre, el símbolo, el número atómico, la masa atómica, el grupo y el período; se puede ordenar por cualquiera de ellos
- Lista de elementos por símbolo
- Lista de elementos por punto de ebullición
- Lista de elementos por punto de fusión
- Lista de elementos por densidad
Páginas relacionadas
- Grupo de la tabla periódica
- Período de la tabla periódica
- Tabla periódica ampliada
Preguntas y respuestas
P: ¿Qué es la tabla periódica?
R: La tabla periódica es un cuadro que ordena todos los elementos químicos conocidos según su número atómico, empezando por el hidrógeno en el número uno. Los elementos con características similares suelen colocarse cerca unos de otros.
P: ¿Cuántos periodos y grupos hay en la tabla periódica estándar?
R: Hay 8 periodos y 18 grupos en la tabla periódica estándar.
P: ¿Qué tienen en común los elementos de un periodo?
R: Los elementos de un periodo tienen números atómicos consecutivos.
P: ¿Qué tienen en común los elementos de un grupo?
R: Los elementos de un grupo tienen los electrones dispuestos de forma similar, según el número de electrones de valencia, lo que les confiere propiedades químicas similares.
P: ¿Quién inventó la tabla periódica?
R: El químico ruso Dmitri Ivánovich Mendeléyev inventó la tabla periódica (1834-1907).
P: ¿Cuáles son los tres grupos principales de la tabla periódica?
R: Los tres grupos principales de la Tabla Periódica son los metales, los metaloides y los no metales.
P: ¿Cómo se pueden observar los patrones y las relaciones entre los elementos utilizando la Tabla Periódica?
R: Se pueden observar patrones y relaciones entre los elementos observando dónde aparecen en la Tabla Periódica; por ejemplo, los elementos situados en la parte inferior izquierda de la misma tienden a ser más metálicos que los situados en la parte superior derecha.
Buscar dentro de la enciclopedia