Electrón | partícula subatómica
Un electrón es un trozo de materia muy pequeño. Su símbolo es e− , fue descubierto por J. J.Thomson en 1897.
El electrón es una partícula subatómica. Todo átomo está formado por algunos electrones que rodean el núcleo del átomo. Un electrón también puede estar separado de cualquier átomo. Se cree que es una partícula elemental porque no puede descomponerse en nada más pequeño. Su carga eléctrica es negativa. Los electrones tienen muy poca masa (poco peso) por lo que se necesita muy poca energía para moverlos rápidamente. Pueden moverse casi a la velocidad de la luz, por ejemplo, como partículas beta, y en las envolturas internas de los electrones de los elementos con un gran número atómico.
Los electrones participan en las interacciones gravitatoria, electromagnética y débil. La fuerza electromagnética es la más fuerte en situaciones comunes. Los electrones se repelen (se alejan) entre sí porque tienen la misma carga eléctrica. Los electrones se atraen a los protones porque tienen carga eléctrica opuesta. Un electrón tiene un campo eléctrico, que describe estas fuerzas. La electricidad que alimenta los televisores, los motores, los teléfonos móviles y muchas otras cosas es en realidad muchos electrones que se mueven a través de cables u otros conductores.
Descripción
Los electrones tienen la carga eléctrica más pequeña. Esta carga eléctrica es igual a la de un protón, pero tiene el signo contrario. Por esta razón, los electrones son atraídos hacia los protones en los núcleos atómicos. Esta atracción hace que los electrones cercanos a un núcleo formen un átomo. Un electrón tiene una masa de aproximadamente 1/1836 veces un protón.
Una forma de pensar en la ubicación de los electrones en un átomo es imaginar que orbitan a distancias fijas del núcleo. De este modo, los electrones de un átomo existen en una serie de cáscaras de electrones que rodean al núcleo central. A cada cáscara de electrones se le asigna un número 1, 2, 3, y así sucesivamente, empezando por la más cercana al núcleo (la cáscara más interna). Cada cáscara puede albergar hasta un determinado número máximo de electrones. La distribución de los electrones en las distintas envolturas se denomina disposición electrónica (o forma electrónica). La disposición electrónica puede mostrarse mediante una numeración o un diagrama de electrones. (Una forma diferente de pensar en la ubicación de los electrones es utilizar la mecánica cuántica para calcular sus orbitales atómicos).
El electrón forma parte de un tipo de partículas subatómicas llamadas leptones. El electrón tiene una carga eléctrica negativa. El electrón tiene otra propiedad, llamada espín. Su valor de espín es 1/2, lo que lo convierte en un fermión.
Aunque la mayoría de los electrones se encuentran en los átomos, otros se mueven de forma independiente en la materia, o juntos como rayos catódicos en el vacío. En algunos superconductores, los electrones se mueven por parejas. Cuando los electrones fluyen, este flujo se denomina electricidad, o corriente eléctrica.
Un objeto puede describirse como "cargado negativamente" si hay más electrones que protones en un objeto, o "cargado positivamente" cuando hay más protones que electrones. Los electrones pueden pasar de un objeto a otro cuando se tocan. Pueden ser atraídos por otro objeto con carga opuesta, o repelidos cuando ambos tienen la misma carga. Cuando un objeto está "conectado a tierra", los electrones del objeto cargado pasan a la tierra, haciendo que el objeto sea neutral. Esto es lo que hacen los pararrayos (pararrayos).
Reacciones químicas
Los electrones en sus envolturas alrededor de un átomo son la base de las reacciones químicas. Las cáscaras exteriores completas, con el máximo de electrones, son menos reactivas. Las envolturas exteriores con menos electrones que el máximo son reactivas. El número de electrones en los átomos es la base subyacente de la tabla periódica química.
Medición
La carga eléctrica puede medirse directamente con un aparato llamado electrómetro. La corriente eléctrica puede medirse directamente con un galvanómetro. La medida emitida por un galvanómetro es diferente de la medida emitida por un electrómetro. Hoy en día los instrumentos de laboratorio son capaces de contener y observar electrones individuales.
Ver' un electrón
En condiciones de laboratorio, las interacciones de los electrones individuales pueden observarse mediante detectores de partículas, que permiten medir propiedades específicas como la energía, el espín y la carga. En una ocasión se utilizó una trampa Penning para contener un solo electrón durante 10 meses. El momento magnético del electrón se midió con una precisión de once dígitos, lo que, en 1980, suponía una exactitud mayor que la de cualquier otra constante física.
Las primeras imágenes de vídeo de la distribución de energía de un electrón fueron captadas por un equipo de la Universidad de Lund (Suecia) en febrero de 2008. Los científicos utilizaron destellos de luz extremadamente cortos, llamados pulsos de attosegundo, que permitieron observar por primera vez el movimiento de un electrón. También se puede visualizar la distribución de los electrones en los materiales sólidos.
Antipartículas
La antipartícula del electrón se llama positrón. Éste es idéntico al electrón, pero lleva cargas eléctricas y de otro tipo de signo opuesto. Cuando un electrón colisiona con un positrón, pueden dispersarse entre sí o aniquilarse totalmente, produciendo un par (o más) de fotones de rayos gamma.
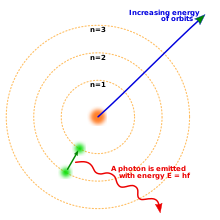
El modelo del átomo de Niels Bohr. Tres envolturas de electrones alrededor de un núcleo, con un electrón moviéndose del segundo al primer nivel y liberando un fotón.
Historia de su descubrimiento
Los efectos de los electrones se conocían mucho antes de que se pudieran explicar. Los antiguos griegos sabían que al frotar el ámbar contra la piel se atraían los objetos pequeños. Ahora sabemos que el frotamiento desprende electrones, y eso da una carga eléctrica al ámbar. Muchos físicos trabajaron en el electrón. J.J. Thomson demostró que existía, en 1897, pero otro hombre le dio el nombre de "electrón".
El modelo de la nube de electrones
El modelo considera que los electrones ocupan posiciones indeterminadas en una nube difusa alrededor del núcleo del átomo.
El principio de incertidumbre significa que una persona no puede conocer la posición y el nivel de energía de un electrón al mismo tiempo. Estos estados potenciales forman una nube alrededor del átomo. Los estados potenciales de los electrones de un átomo forman una nube única y uniforme.
Páginas relacionadas
- Positrones
- Proton
- Neutrón
Preguntas y respuestas
P: ¿Qué es un electrón?
R: Un electrón es un trozo de materia muy pequeño y es una partícula subatómica. No puede descomponerse en nada más pequeño y tiene una carga eléctrica negativa.
P: ¿Quién descubrió el electrón?
R: El electrón fue descubierto por J.J. Thomson en 1897.
P: ¿Qué masa tiene un electrón?
R: Los electrones tienen muy poca masa, o peso, por lo que se necesita muy poca energía para moverlos rápidamente.
P: ¿En qué tipo de interacciones participan los electrones?
R: Los electrones participan en interacciones gravitatorias, electromagnéticas y débiles. La fuerza electromagnética es la más fuerte en situaciones comunes.
P: ¿Cómo interactúan los electrones entre sí?
R: Los electrones se repelen entre sí porque tienen la misma carga eléctrica, pero se sienten atraídos por los protones porque tienen cargas eléctricas opuestas.
P: ¿Qué hace funcionar los televisores, los motores, los teléfonos móviles y muchas otras cosas?
R: La electricidad que alimenta estos aparatos es en realidad muchos electrones que se mueven a través de cables u otros conductores.
Buscar dentro de la enciclopedia