Molécula: definición, estructura, enlaces y estados de la materia
Definición de molécula, estructura y tipos de enlaces, ejemplos como la glucosa y su comportamiento en sólidos, líquidos, gases y plasma
Una molécula es la cantidad más pequeña de una sustancia química que mantiene sus propiedades químicas. Si se divide una molécula en partes más pequeñas, esas partes dejan de comportarse como la misma sustancia y, por tanto, son diferentes desde el punto de vista químico.
Estructura y composición
Las moléculas están formadas por átomos unidos entre sí en una disposición concreta; por eso se decía que están formadas por átomos pegados de una forma determinada. No todas las combinaciones ni todas las geometrías son posibles: los átomos tienden a conectarse según su valencia y la naturaleza de los enlaces que pueden formar. Por ejemplo, los átomos de oxígeno siempre tienen dos enlaces con otros átomos, los de carbono suelen formar cuatro enlaces y los de nitrógeno normalmente hacen tres enlaces. Esa tendencia condiciona la estructura tridimensional de la molécula y sus propiedades.
Enlaces químicos: cómo se forman las moléculas
Las moléculas se mantienen unidas por distintos tipos de enlaces químicos:
- Enlace covalente: compartición de electrones entre átomos (p. ej., H–H, O=O, C–H). Es el tipo más común en moléculas neutras orgánicas e inorgánicas.
- Enlace iónico: atracción electrostática entre iones de cargas opuestas (más típico en compuestos iónicos como NaCl; en sentido estricto, los sólidos iónicos forman redes iónicas más que moléculas discretas).
- Enlace metálico: en metales, los electrones se delocalizan y “unen” a los núcleos formando una estructura colectiva.
- Interacciones intermoleculares: fuerzas más débiles entre moléculas (fuerzas de Van der Waals, dipolo–dipolo y enlaces de hidrógeno) que determinan propiedades como punto de ebullición, solubilidad y viscosidad.
Para representar la distribución de electrones y prever la reactividad se usan herramientas como las estructuras de Lewis, las fórmulas estructurales y la teoría de orbitales moleculares (que explica la formación de enlaces en términos cuánticos y la presencia de orbitales enlazantes y antienlazantes).
Geometría molecular y polaridad
La geometría de una molécula (lineal, trigonal plana, tetraédrica, piramidal, etc.) viene dada por la disposición espacial de sus átomos y los pares de electrones alrededor del átomo central. Esa geometría determina si la molécula es polara o apolar, lo que influye en su solubilidad y en las fuerzas intermoleculares que experimenta. Por ejemplo, H2O es polar y forma puentes de hidrógeno; CO2 es lineal y, pese a tener enlaces polares, en conjunto es apolar.
Tipos de moléculas
- Monoatómicas: formadas por un solo átomo (aunque habitualmente no se llaman “moléculas” en todos los contextos; por ejemplo, los gases nobles son átomos monoatómicos en fase gaseosa).
- Diatómicas: formadas por dos átomos iguales o distintos (O2, N2, CO).
- Poliatómicas: con tres o más átomos (H2O, CH4, C6H12O6).
- Moléculas orgánicas: basadas en carbono, con enlaces C–H, C–C y grupos funcionales que determinan su química.
Estados de la materia y comportamiento molecular
El comportamiento de las moléculas varía según el estado de la materia:
- En la teoría cinética de los gases, el término molécula suele usarse para cualquier partícula gaseosa, independientemente de su composición. En el gas las moléculas se mueven libremente y chocan entre sí y con las paredes del recipiente; la energía cinética media de esas partículas está ligada a la temperatura.
- En los líquidos, como el agua, las moléculas están más próximas y hay interacciones intermoleculares significativas que permiten el flujo pero limitan la separación completa.
- En los sólidos, como el azúcar, las moléculas están ordenadas o empaquetadas y sólo pueden vibrar alrededor de posiciones fijas; en sólidos iónicos o covalentes la estructura puede ser una red extensa.
- En el cuarto estado de la materia, el plasma, los átomos están ionizados y la fuerte separación entre electrones y núcleos impide la formación estable de moléculas en la mayoría de las condiciones.
Fórmulas y representación
Con una fórmula molecular se indican los números de cada tipo de átomo en la molécula. Por ejemplo, la fórmula molecular de la glucosa es C 6H12 O6, lo que significa que una molécula de glucosa contiene seis átomos de carbono, doce de hidrógeno y seis de oxígeno. Además de la fórmula molecular existen:
- Fórmula empírica: relación más simple de átomos (por ejemplo, para H2O la empírica es H2O y para C6H12O6 es CH2O).
- Fórmulas estructurales: muestran cómo están unidos los átomos y permiten diferenciar isómeros que comparten fórmula molecular pero no conectividad.
- Masa molecular (molar): suma de las masas atómicas de los átomos que forman la molécula; se usa para cálculos estequiométricos y para convertir entre cantidad de sustancia (moles) y masa.
Diferencias entre moléculas, átomos y compuestos
Un átomo es la unidad más pequeña de un elemento químico. Una molécula es un conjunto de átomos unidos que puede corresponder a un elemento diatómico (O2) o a un compuesto (H2O, CO2). Un compuesto químico es una sustancia formada por dos o más elementos en proporciones definidas; muchas sustancias compuestas están formadas por moléculas discretas, pero otras forman redes (p. ej., grafito, diamante o sales iónicas).
Propiedades y aplicación práctica
Las moléculas determinan propiedades macroscópicas como el punto de fusión, ebullición, solubilidad, conductividad eléctrica y reactividad química. El estudio de las moléculas es fundamental en campos como la bioquímica (proteínas, ADN), la farmacología (diseño de fármacos), los materiales (plásticos, nanomateriales) y la energía (combustibles, reacciones redox).
En resumen, las moléculas son unidades formadas por átomos unidos por enlaces químicos cuya estructura y tipo de enlace determinan gran parte de las propiedades físicas y químicas de las sustancias que observamos en la naturaleza y en la tecnología.
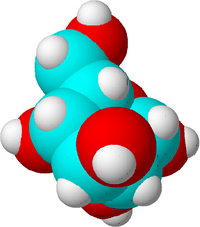
Esta es una molécula de azúcar. Los átomos de carbono se han hecho azules, los de oxígeno rojos y los de hidrógeno blancos para mostrar la diferencia. En realidad, los átomos no tienen color.
Vinculación
Para que exista una molécula, los átomos tienen que unirse. Esto ocurre cuando dos átomos comparten electrones. En lugar de rodear a un solo átomo, el electrón pasa a rodear a dos. Esto se llama enlace covalente. A veces, se comparte más de un electrón. Cuantos más electrones se compartan, más fuerte será el enlace y más fuertes serán los átomos que se mantengan unidos.
Los enlaces también pueden romperse. Como la mayoría de los enlaces requieren energía para formarse, también desprenden energía cuando se rompen. Pero antes de que la mayoría de los enlaces se rompan, la molécula tiene que calentarse. Entonces los átomos empiezan a moverse y, cuando se mueven demasiado, el enlace se rompe. Las moléculas que necesitan menos energía para romperse que la que desprenden cuando se rompen se llaman combustibles. Por ejemplo, una vela se queda ahí y no pasa nada. Pero si usas una cerilla para encenderla, arderá durante mucho tiempo. La cerilla aporta la energía necesaria para romper los primeros enlaces, que liberan suficiente energía para romper los enlaces que están por debajo, hasta que la vela se ha consumido.
También hay enlaces iónicos.
Preguntas y respuestas
P: ¿Qué es una molécula?
R: Una molécula es la cantidad más pequeña que puede existir de una sustancia química. Está formada por átomos pegados entre sí de una forma determinada.
P: ¿Cuántos enlaces tienen los átomos de oxígeno, carbono y nitrógeno?
R: Los átomos de oxígeno siempre tienen dos enlaces con otros átomos, los átomos de carbono siempre tienen cuatro enlaces con otros átomos y los átomos de nitrógeno siempre tienen tres enlaces con otros átomos.
P: ¿Qué afirma la teoría cinética de los gases sobre las moléculas?
R: Según la teoría cinética de los gases, el término molécula suele utilizarse para cualquier partícula gaseosa independientemente de su composición. Esto significa que los átomos de gases nobles se consideran moléculas, ya que en realidad son moléculas monoatómicas.
P: ¿Cómo se comportan las moléculas en diferentes estados?
R: En los gases como el aire, las moléculas simplemente vuelan de un lado a otro. En los líquidos como el agua, las moléculas están pegadas pero aún pueden moverse. En los sólidos como el azúcar, las moléculas sólo pueden vibrar. En el plasma (el cuarto estado de la materia), los átomos están ionizados y no pueden formar moléculas.
P: ¿Qué es una fórmula molecular?
R: Una fórmula molecular se utiliza para escribir los números de todos los átomos de una molécula. Por ejemplo, C6H12O6 indica una molécula de glucosa que está formada por seis átomos de carbono, doce átomos de hidrógeno y seis átomos de oxígeno.
Buscar dentro de la enciclopedia