Estados de la materia: definición y propiedades de sólido, líquido, gas y plasma
Descubre qué son y cómo se comportan los cuatro estados de la materia —sólido, líquido, gas y plasma— y sus propiedades clave: densidad, viscosidad, maleabilidad y conductividad.
Existen cuatro estados comunes de la materia (o fases) en el universo: sólido, líquido, gas y plasma. El estado de la materia afecta a las propiedades de una sustancia, como la densidad, la viscosidad (lo bien que fluye), la maleabilidad (lo fácil que es doblarla) y la conductividad. Estas propiedades dependen principalmente de la energía de las partículas (temperatura) y de la presión del entorno.
Sólidos
Los sólidos tienen partículas (átomos o moléculas) fuertemente unidas que vibran alrededor de posiciones fijas. Por eso los sólidos mantienen forma y volumen definidos. Propiedades típicas:
- Densidad: suele ser alta comparada con líquidos y gases.
- Rigidez y forma: resisten cambios de forma; algunos son dúctiles o maleables, otros son frágiles.
- Conductividad: varía mucho; algunos sólidos (metales) conducen bien el calor y la electricidad, otros (aislantes) no.
Ejemplos: hierro, hielo, madera, vidrio. Transiciones comunes: fusión (sólido → líquido) y sublimación (sólido → gas) en condiciones apropiadas.
Líquidos
Los líquidos tienen partículas próximas pero con mayor libertad de movimiento que en los sólidos, lo que les permite cambiar de forma adoptando la del recipiente, aunque mantienen volumen casi constante.
- Viscosidad: medida de la resistencia al flujo; el agua tiene baja viscosidad, la miel alta.
- Incompresibilidad relativa: los líquidos son poco compresibles comparados con los gases.
- Tensión superficial: genera fenómenos como gotas y capilaridad.
Ejemplos: agua, aceite, mercurio. Transiciones: congelación (líquido → sólido) y vaporización/ebullición (líquido → gas).
Gases
En un gas las partículas están muy separadas y se mueven libremente, llenando el volumen disponible. Los gases son altamente compresibles y su densidad depende fuertemente de la presión y la temperatura.
- Expansión: ocupan todo el espacio disponible.
- Compresibilidad: se pueden comprimir aumentando la presión.
- Difusión: se mezclan rápidamente con otros gases.
Ejemplos: aire, vapor de agua, dióxido de carbono. Transiciones: condensación (gas → líquido) y sublimación inversa o deposición (gas → sólido).
Plasma
El plasma es un gas ionizado formado por electrones libres y iones positivos; aparece a temperaturas muy altas o por campos eléctricos intensos. Las partículas están tan energizadas que los electrones se separan de los núcleos.
- Conductividad eléctrica: muy alta, responde a campos magnéticos y eléctricos.
- Emisión de luz: es frecuente que el plasma emita luz visible (p. ej., la corona de una estrella).
- Presencia en el universo: la mayor parte del universo visible está en forma de plasma (estrellas, viento solar, nebulosas).
Ejemplos en la Tierra: relámpagos, auroras, las pantallas fluorescentes y algunas aplicaciones industriales (corte por plasma). Transición típica: ionización (gas → plasma) y recombinación (plasma → gas).
Factores que cambian el estado de la materia
- Temperatura: aumentar la temperatura suele mover la materia hacia estados con más energía cinética (sólido → líquido → gas → plasma).
- Presión: puede favorecer estados más compactos; por ejemplo, aumentar la presión puede solidificar un líquido o transformar un gas en líquido.
- Composición y fuerzas intermoleculares: la naturaleza química y las fuerzas entre partículas determinan puntos de fusión, ebullición y otras propiedades.
Otros estados y notas finales
Además de los cuatro estados clásicos existen otros estados de la materia estudiados en física avanzada, como el condensado de Bose–Einstein o los estados cuánticos en materiales a bajas temperaturas. Sin embargo, para la vida cotidiana y la mayor parte de la naturaleza observada, los cuatro estados descritos (sólido, líquido, gas y plasma) son los más relevantes.
Cambios de fase habituales en la naturaleza
Estados comunes de la materia
Sólidos
En un sólido, las posiciones de los átomos se mantienen fijas entre sí durante mucho tiempo. Esto se debe a la cohesión o "fricción" entre las moléculas. Esta cohesión la proporcionan los enlaces metálicos, covalentes o iónicos. Sólo los sólidos pueden ser empujados por una fuerza sin cambiar de forma, lo que significa que pueden ser resistentes a la deformación. Los sólidos también suelen ser lo suficientemente fuertes como para mantener su propia forma en un recipiente. Los sólidos suelen ser más densos que los líquidos. El hecho de que un sólido se convierta en un gas se denomina sublimación.
Líquidos
En un líquido, las moléculas se atraen entre sí con la suficiente fuerza como para mantenerlas en contacto, pero no con la suficiente fuerza como para mantener una estructura determinada. Las moléculas pueden moverse continuamente unas respecto a otras. Esto significa que los líquidos pueden fluir suavemente, pero no tanto como los gases. Los líquidos tienden a adoptar la forma del recipiente en el que se encuentran. Los líquidos suelen ser menos densos que los sólidos, pero más que los gases.
Gases
En un gas, los enlaces químicos no son lo suficientemente fuertes como para mantener unidos los átomos o las moléculas, por lo que un gas es un conjunto de moléculas independientes y sin enlaces que interactúan principalmente por colisión. Los gases tienden a adoptar la forma de su recipiente y son menos densos que los sólidos y los líquidos. Los gases tienen fuerzas de atracción más débiles que los sólidos y los líquidos. El hecho de que un gas se convierta directamente en un sólido se denomina deposición.
En ocasiones, los gases pueden convertirse directamente en sólidos sin pasar por una etapa de fluidos. Esto se llama desublimación. Se ve en la escarcha que se forma en los cristales de las ventanas en los climas fríos. Es lo contrario de la sublimación.
Plasmas
Los plasmas son gases que tienen tanta energía que los electrones de un átomo no pueden permanecer en órbita alrededor de un núcleo atómico. Los iones atómicos y los electrones libres se mezclan como una sopa caliente.
Como las partículas cargadas positiva y negativamente no están pegadas, el plasma es un buen conductor de electricidad. Por ejemplo, el aire no es un buen conductor de la electricidad. Sin embargo, en un rayo, los átomos del aire reciben tanta energía que ya no pueden retener sus electrones y se convierten en plasma durante un breve tiempo. Entonces, una corriente eléctrica es capaz de fluir a través del plasma, creando el rayo.
El plasma es el estado más común de la materia en el universo. Tanto las estrellas como el medio interestelar están formados en su mayoría por plasma.
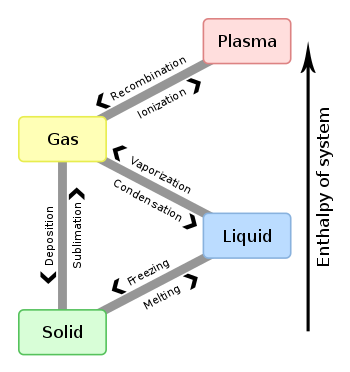
Cambios de fase
Las fases de la materia pueden cambiar por una serie de cosas. Las más comunes son la temperatura y la presión. Las sustancias suelen convertirse en gas a temperaturas cálidas y/o bajas presiones, se convierten en sólido a temperaturas frías y se convierten en plasma a temperaturas extremadamente altas. Las sustancias a menudo se convierten en líquido entre el sólido y el gas, pero cuando la presión es muy baja (como el vacío del espacio exterior) muchas sustancias se saltan la fase líquida, pasando directamente de sólido a gas o viceversa. Los científicos han creado gráficos llamados diagramas de cambio de fase para mostrar la relación entre la presión, la temperatura y la fase de muchas sustancias.
Cuando un sólido se convierte en líquido, se llama fusión. Cuando un líquido se convierte en un sólido, se denomina congelación. Cuando un sólido se convierte en gas, se denomina sublimación. Cuando un gas se convierte en un sólido, se llama desublimación. Cuando un líquido se convierte en gas, se denomina evaporación. Cuando un gas se convierte en líquido, se llama condensación.
Se dice que el punto de congelación y el punto de fusión son iguales, porque cualquier aumento de temperatura a partir de ese punto hará que la sustancia se funda, mientras que cualquier descenso de temperatura hará que se congele. Del mismo modo, los puntos de vaporización y condensación (o los puntos de sublimación y desublimación) siempre coinciden. En la mayoría de las sustancias, a medida que aumenta la presión, también aumenta el punto de vaporización/condensación, o viceversa. Por ejemplo, el punto de ebullición del agua disminuye al subir una montaña, porque la presión atmosférica es menor. La relación para la congelación y la fusión puede ir en distintas direcciones según la sustancia.
Otros estados
Pueden existir muchos otros estados de la materia en condiciones especiales, como la materia extraña, los supersólidos y, posiblemente, los líquidos de red. Los científicos trabajan en experimentos a temperaturas muy altas o muy bajas para conocer mejor las fases de la materia.
Condensados
Los condensados de Bose-Einstein y los condensados fermiónicos son fases de la materia que se aplican a las partículas llamadas bosones y fermiones, respectivamente. (Puede existir más de un bosón en el mismo lugar al mismo tiempo. Sólo puede existir un fermión en el mismo punto al mismo tiempo). Los condensados de Bose-Einstein y los condensados fermiónicos se producen a temperaturas increíblemente bajas (unos 4° Kelvin, que es lo mismo que -452° Fahrenheit). Todas las partículas de estos condensados comienzan a actuar como un gran estado cuántico, por lo que casi no tienen fricción ni resistencia eléctrica.
Materia degenerada
Cuando el núcleo de una estrella se queda sin elementos ligeros (como el hidrógeno o el helio) para mantener la fusión, el núcleo colapsa en un estado muy denso llamado materia degenerada. Todo está muy apretado y apenas puede moverse. Si la estrella no es demasiado pesada, se convierte en una enana blanca. En una estrella más pesada, la presión es tan intensa que incluso los protones y los electrones son aplastados, y se convierte en una estrella de neutrones.
Plasmas de cuarzo-gluón
Los protones y neutrones que forman los átomos están hechos de cosas aún más pequeñas llamadas quarks (que están "pegados" por cosas llamadas "gluones"). A temperaturas increíblemente altas, por encima de los 2 billones de Kelvin, los quarks y los gluones se convierten en otro estado de la materia. Los humanos pueden hacer un poco de plasma de quarks y gluones en el Gran Colisionador de Hadrones del CERN, pero no dura mucho antes de enfriarse.
Fluidos supercríticos
Cuando una sustancia tiene suficiente temperatura y presión al mismo tiempo, lo que se denomina punto crítico, no se puede distinguir entre un gas muy denso y un líquido muy energético. Se trata de un fluido supercrítico, que se comporta tanto como un líquido como un gas.
Superfluidos
Los superfluidos, en cambio, sólo se producen a temperaturas muy bajas y sólo en el caso de algunas sustancias especiales, como el helio líquido. Los superfluidos pueden hacer cosas que los líquidos normales no pueden, como fluir por el lado de un cuenco y salir.
Buscar dentro de la enciclopedia