Ácidos: qué son, propiedades, pH y tipos (fuertes y débiles)
Descubre qué son los ácidos, sus propiedades, el pH y la diferencia entre ácidos fuertes y débiles con explicaciones claras y ejemplos prácticos.
El artículo sobre ciertas propiedades de las bases de datos está en ACID
A veces el ácido es otro nombre para la droga LSD (dietilamida del ácido lisérgico)
Un ácido es una sustancia que puede donar un ion hidrógeno (H+) (en general, será un protón) a otra sustancia. Los ácidos tienen un pH inferior a 7,0. Una sustancia química puede donar un protón si el átomo de hidrógeno está unido a un átomo electronegativo como el oxígeno, el nitrógeno o el cloro. Algunos ácidos son fuertes y otros son débiles. Los ácidos débiles retienen algunos de sus protones, mientras que los ácidos fuertes los sueltan todos. Todos los ácidos liberan iones de hidrógeno en las disoluciones. La cantidad de iones que se liberan por molécula determinará si el ácido es débil o fuerte. Los ácidos débiles son ácidos que liberan parcialmente los átomos de hidrógeno que tienen adheridos. Por tanto, estos ácidos pueden reducir el pH por disociación de los iones de hidrógeno, pero no completamente. Los ácidos débiles suelen tener un valor de pH de 4 a 6, mientras que los fuertes tienen un valor de pH de 1 a 3.
Una base es el "opuesto químico" de un ácido. Una base es una sustancia que acepta el átomo de hidrógeno del ácido. Las bases son moléculas que pueden separarse en el agua y liberar iones de hidróxido.
Teorías para definir ácidos y bases
Existen varias definiciones que amplían el concepto de ácido:
- Arrhenius: ácido es una sustancia que aumenta la concentración de H+ en disolución acuosa; base aumenta OH−.
- Brønsted–Lowry: ácido es un donador de protones (H+); base es un aceptor de protones. Esta definición es más general que la de Arrhenius y se aplica fuera del agua.
- Lewis: ácido es un aceptador de pares de electrones; base es un donador de pares de electrones. Incluye reacciones donde no intervienen protones.
pH y concentración de iones
El pH mide la acidez de una disolución y se define como pH = −log[H+]. En agua pura [H+] ≈ 1·10−7 mol·L−1, por eso pH = 7. Los valores menores de 7 son ácidos, mayores de 7 son básicos. En disoluciones acuosas reales, los protones existen fuertemente asociados al agua como H3O+ (ión hidronio) o en complejos hidratados.
Fuerza de los ácidos: Ka y pKa
La fuerza de un ácido en solución se cuantifica por su constante de disociación ácida, Ka:
Ka = [H+][A−]/[HA]
Donde HA es el ácido no disociado y A− su base conjugada. Un Ka grande indica un ácido fuerte (mayor disociación). Es habitual usar pKa = −log Ka; cuanto menor el pKa, más fuerte es el ácido.
La relación entre pH, pKa y las concentraciones de ácido y base conjugada está dada por la ecuación de Henderson–Hasselbalch:
pH = pKa + log([A−]/[HA])
Ejemplos y clasificación
- Ácidos fuertes (disocian casi completamente en agua): HCl (ácido clorhídrico), HBr, HI, HNO3 (ácido nítrico), HClO4 (ácido perclórico), H2SO4 (primer protón). Su pH en disoluciones diluidas suele estar en torno a 0–3.
- Ácidos débiles (disocian parcialmente): CH3COOH (ácido acético), HF (ácido fluorhídrico), H2CO3 (ácido carbónico), HCN, ácidos orgánicos (cítrico, láctico). Su pH en solución suele ser más cercano a 3–6, dependiendo de la concentración y pKa.
- Ácidos polipróticos: pueden donar más de un protón (por ejemplo, H2SO4, H3PO4). Cada protón tiene su propia Ka y pKa.
Reacciones características
- Neutralización: ácido + base → sal + agua. Ejemplo: HCl + NaOH → NaCl + H2O.
- Reacciones ácido-base en agua: HA + H2O ⇌ H3O+ + A−.
- Formación de sales y tamices: Las reacciones ácido-base se usan para preparar sales y en titulaciones para determinar concentraciones desconocidas.
Titulaciones e indicadores
En una titulación ácido-base se mide el volumen de titulante necesario para alcanzar el punto de equivalencia. El pH en ese punto depende de la fuerza relativa del ácido y la base. Se usan indicadores que cambian de color en intervalos de pH concretos (por ejemplo, la fenolftaleína cambia alrededor de pH 8–10; el naranja de metilo alrededor de pH 3–4).
Propiedades físicas y usos
- Los ácidos suelen tener sabor agrio (en alimentos: ácido cítrico, ácido acético), son corrosivos en concentraciones elevadas.
- Usos: industria química, limpieza (ácido clorhídrico diluido en desincrustantes), baterías (ácido sulfúrico), conservantes y aditivos alimentarios (ácido ascórbico, cítrico), síntesis orgánica.
Peligros y manejo seguro
Los ácidos concentrados pueden causar quemaduras químicas, daños en ojos y corrosión de materiales. Medidas de seguridad:
- Usar guantes resistentes a productos químicos, protección ocular y ropa adecuada.
- Trabajar en campana extractora si hay vapores peligrosos.
- Al diluir ácidos concentrados, verter siempre el ácido sobre el agua lentamente (nunca al revés) para evitar salpicaduras y calentamiento súbito.
- Neutralizar derrames con materiales adecuados y seguir los procedimientos locales de seguridad.
Resumen
Un ácido es una sustancia que dona protones (H+) o acepta pares de electrones según la definición usada. La fuerza de un ácido depende de cuánto se disocia en solución, cuantificada por Ka y pKa. El pH mide la acidez de una disolución, y las reacciones ácido-base son fundamentales en química, biología, industria y vida cotidiana. Las precauciones de seguridad son esenciales al manipular ácidos concentrados.

El ácido clorhídrico (en el vaso de precipitados) reacciona con los vapores de amoníaco para producir cloruro de amonio (humo blanco).
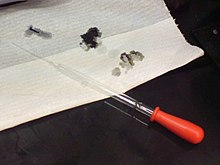
Los ácidos pueden ser peligrosos: Los agujeros en el papel fueron hechos por una solución con 98% de ácido sulfúrico.
Cómo funcionan los ácidos
Los ácidos y las bases suelen existir juntos en equilibrio. Esto significa que dentro de una muestra de un ácido, algunas moléculas cederán sus protones y otras los aceptarán. Incluso el agua es una mezcla de un ion ácido, H3 O+ (llamado ion hidronio) y un ion básico, OH- (llamado ion hidróxido). Un ion hidronio cederá su protón a un ion hidróxido, formando dos moléculas de H 2O, que es neutro. Esta reacción ocurre continuamente en una muestra de agua, pero en general la muestra es neutra porque hay cantidades iguales de hidronio e hidróxido en la muestra. Sin embargo, en la mayoría de las reacciones, los ácidos y las bases no están presentes en cantidades iguales, y este desequilibrio es lo que permite que se produzca una reacción química.
Todo ácido tiene una base conjugada que se forma al eliminar el protón del ácido. El ácido clorhídrico (HCl), por ejemplo, es un ácido y su base conjugada es un anión de cloro, o Cl-. Un ácido y su base conjugada son opuestos en fuerza. Como el HCl es un ácido fuerte, el Cl -es una base débil.
Propiedades
Los ácidos pueden tener diferentes potencias, algunos son más reactivos que otros. Los ácidos más reactivos suelen ser más peligrosos.
Los ácidos pueden tener muchas propiedades diferentes según su estructura molecular. La mayoría de los ácidos tienen las siguientes propiedades:
- tienen un sabor agrio cuando se comen
- pueden picar la piel cuando se tocan
- puede corroer (o corroer) los metales y la piel
- puede utilizarse como reactivo durante la electrólisis debido a la presencia de iones móviles
- volver rojo el papel de tornasol azul
- se pone rojo o naranja en el indicador universal
- conducir la electricidad
Los ácidos pueden quemar la piel, la gravedad de la quemadura depende del tipo y la concentración del ácido. Estas quemaduras químicas requieren atención médica inmediata.
Como los ácidos donan iones de hidrógeno, todos los ácidos deben tener hidrógeno.

Imagen de advertencia utilizada con ácidos peligrosos y bases peligrosas. Las bases son los opuestos de los ácidos.
Importancia
Los ácidos son importantes. Los ácidos nucleicos, como el ADN y el ARN, contienen el código genético. Estas moléculas determinan muchas características de un organismo, se transmiten de los padres a la descendencia. El ADN contiene los planes para construir proteínas, que están formadas por aminoácidos.
Los ácidos grasos y sus derivados son otro grupo de ácidos carboxílicos que desempeñan un papel importante en la biología. Contienen largas cadenas de hidrocarburos y un grupo de ácido carboxílico en un extremo. La membrana celular de casi todos los organismos está formada principalmente por una bicapa de fosfolípidos, una micela de cadenas de ácidos grasos hidrofóbicos con grupos "cabeza" de fosfato polares e hidrofílicos.
En el ser humano y en muchos otros animales, el ácido clorhídrico forma parte del ácido gástrico que se segrega en el estómago. Puede ayudar a hidrolizar proteínas y polisacáridos. También puede convertir la pro-enzima inactiva, el pepsinógeno, en la enzima pepsina. Algunos organismos producen ácidos para defenderse; por ejemplo, las hormigas producen ácido fórmico y los pulpos un ácido negro llamado magneta.
La mayoría de los ácidos se encuentran en la naturaleza. Algunos de ellos son los siguientes:
- El vinagre es probablemente uno de los más conocidos; contiene ácido acético, que le da su conocido sabor.
- El ácido nítrico, NHO3, se conoce desde aproximadamente el siglo XIII.
- Los ácidoscítricos, C6 H8 O7, se encuentran en muchos tipos de fruta. Probablemente fueron descubiertos por Geber en el siglo VIII.
- El ácido láctico, C3 H6 O, 3fue descubierto por Carl Wilhelm Scheele en 1780. Se encuentra en los productos lácteos agrios, como el yogur.
- El ácido sulfúrico, H2 SO, 4fue descubierto probablemente por Geber. Hoy en día se puede encontrar en las pilas.
Páginas relacionadas
- Álcali
- Ácido fólico
Preguntas y respuestas
P: ¿Qué es el ÁCIDO?
R: El ÁCIDO es un artículo sobre ciertas propiedades de las bases de datos.
P: ¿Qué es el ácido en general?
R: Un ácido en general es una sustancia que puede donar un ion hidrógeno (H+) a otra sustancia, con un pH inferior a 7,0.
P: ¿Cuáles son las condiciones en las que una sustancia química puede donar un protón?
R: Una sustancia química puede donar un protón si el átomo de hidrógeno está unido a un átomo electronegativo como el oxígeno, el nitrógeno o el cloro.
P: ¿Cuál es la diferencia entre ácidos fuertes y ácidos débiles?
R: Los ácidos fuertes sueltan todos sus protones, mientras que los débiles retienen algunos de ellos. La cantidad de iones que se liberan por molécula determinará si el ácido es débil o fuerte.
P: ¿Cuál es el intervalo de pH de los ácidos débiles y los ácidos fuertes?
R: Por lo general, los ácidos débiles tienen un valor de pH de 4 a 6, mientras que los ácidos fuertes tienen un valor de pH de 1 a 3.
P: ¿Qué es una base?
R: Una base es el "opuesto químico" de un ácido. Una base es una sustancia que aceptará el átomo de hidrógeno del ácido. Las bases son moléculas que pueden separarse en el agua y liberar iones de hidróxido.
P: ¿Qué es el LSD?
R: El LSD (dietilamida del ácido lisérgico) es una droga que a veces se denomina ácido, pero no está relacionada con el ácido mencionado en este artículo.
Buscar dentro de la enciclopedia