Orbital molecular | explica lo que ocurre con los electrones cuando los átomos se unen en una molécula
En química, un orbital molecular (o MO) explica lo que ocurre con los electrones cuando los átomos se unen en una molécula. Un MO es una función matemática que describe el comportamiento ondulatorio de un electrón en una molécula. Las funciones pueden indicar la probabilidad de encontrar un electrón en una región específica. Los químicos utilizan estas funciones para predecir o explicar las propiedades químicas y físicas.
Los químicos suelen construir modelos matemáticos de orbitales moleculares combinando orbitales atómicos. También se pueden utilizar orbitales híbridos de cada átomo de la molécula u otros orbitales moleculares de grupos de átomos. Los ordenadores pueden trabajar con estas funciones. Los orbitales moleculares permiten a los químicos aplicar la mecánica cuántica al estudio de las moléculas. Los orbitales moleculares responden a preguntas sobre cómo se unen los átomos en las moléculas. Las distintas formas redondeadas de un diagrama de orbitales indican dónde es más probable que se encuentren los electrones en un átomo.
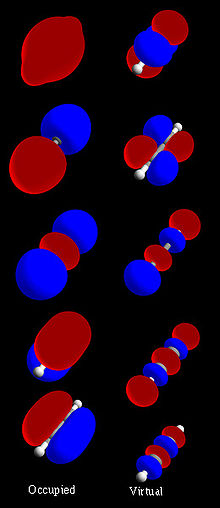
Figura 1: Conjunto de orbitales moleculares del acetileno (H-C≡C-H)
Historia
La palabra orbital fue utilizada por primera vez en inglés por Robert S. Mulliken. El físico alemán Erwin Schrödinger escribió antes sobre las MO. Schrödinger las llamó Eigenfunktion.
El físico Max Born describió la teoría de los orbitales moleculares en 1926. Hoy se conoce como la regla de Born y forma parte de la interpretación de Copenhague de la mecánica cuántica. Cuando se propuso inicialmente, esta teoría no coincidía con el modelo del átomo de Niels Bohr. El modelo de Bohr describía que los electrones "orbitaban" el núcleo, ya que se movían en círculos. Sin embargo, el modelo de Born acabó ganando apoyo popular porque era capaz de describir la ubicación de los electrones dentro de las moléculas y explicaba una serie de reacciones químicas antes inexplicables.
Resumen
Los orbitales atómicos predicen la posición de un electrón en un átomo. Los orbitales moleculares se crean cuando se juntan los orbitales atómicos. Un orbital molecular puede dar información sobre la configuración electrónica de una molécula. La configuración electrónica es la posición más probable y la energía de uno (o un par de) electrones. La mayoría de las veces, un MO se representa como una combinación lineal de orbitales atómicos (el método LCAO-MO), especialmente en el uso aproximado. Esto significa que los químicos asumen que la probabilidad de que un electrón se encuentre en cualquier punto de la molécula es la suma de las probabilidades de que el electrón esté allí según los orbitales atómicos individuales. El LCAO-MO es un modelo sencillo de enlace en las moléculas y es importante para estudiar la teoría de los orbitales moleculares.
Los químicos teóricos utilizan ordenadores para calcular los MO de diferentes moléculas (tanto reales como imaginarias). El ordenador puede dibujar gráficos de la "nube" para mostrar la probabilidad de que el electrón se encuentre en cualquier región. Los ordenadores también pueden dar información sobre las propiedades físicas de la molécula. También pueden decir cuánta energía se necesita para formar la molécula. Esto ayuda a los químicos a decir si algunas moléculas pequeñas pueden combinarse para formar moléculas más grandes.
La mayoría de las formas actuales de hacer química computacional comienzan calculando las MO de un sistema. El campo eléctrico de cada MO es generado por los núcleos de todos los átomos y alguna distribución media de los demás electrones.
Analogía
Entender las MO es como la tarea de saber dónde está cada empleado en una gran tienda de artículos para el hogar (sin mirar dentro de la tienda). Un analista conoce el número de empleados que trabajan en la tienda y el departamento de cada empleado. También sabe que los empleados no se pisan unos a otros y que los empleados se sitúan en el pasillo y no en los estantes de la mercancía. Los empleados abandonan su propio departamento para ayudar a los clientes a localizar la mercancía en otros departamentos o para comprobar el inventario. Que un analista dé la ubicación de todos los empleados de la tienda en un momento determinado sin mirar dentro es como si un químico calculara las MO de una molécula. Al igual que las MO no pueden decir la ubicación exacta de cada electrón, no se conoce la ubicación exacta de cada empleado. Una MO que tenga un plano nodal es como la conclusión de que los empleados caminan por los pasillos y no por las estanterías. Aunque los electrones se aportan desde un átomo específico, el electrón llena una MO sin tener en cuenta su átomo de origen. Esto es como si un empleado abandonara su departamento para caminar por otro lugar de la tienda durante el día. Así pues, una MO es una descripción incompleta de un electrón, al igual que los cálculos del analista sobre la tienda que no se ve son una conjetura incompleta sobre la ubicación de los empleados.

Calcular las MO es como predecir la ubicación de cada empleado en una tienda de artículos para el hogar.
Formación de orbitales moleculares
Los químicos teóricos han inventado reglas para calcular las MO. Estas reglas provienen de la comprensión de la mecánica cuántica. La mecánica cuántica ayuda a los químicos a utilizar lo que la física dice sobre los electrones para averiguar cómo se comportan los electrones en las moléculas. Los orbitales moleculares se forman a partir de las interacciones "permitidas" entre los orbitales atómicos. (Las interacciones están "permitidas" si las simetrías (determinadas a partir de la teoría de grupos) de los orbitales atómicos son compatibles entre sí). Los químicos estudian las interacciones de los orbitales atómicos. Estas interacciones provienen del solapamiento (una medida de lo bien que interactúan constructivamente dos orbitales entre sí) entre dos orbitales atómicos. El solapamiento es importante si los orbitales atómicos están próximos en energía. Por último, el número de MO de una molécula debe ser igual al número de orbitales atómicos de los átomos que se unen para formar la molécula.
Enfoque cualitativo
Los químicos necesitan comprender la geometría de los MO para poder discutir la estructura molecular. El método LCMO (combinación lineal de orbitales atómicos orbitales moleculares) ofrece una descripción aproximada pero buena de los MO. En este método, los orbitales moleculares se expresan como combinaciones lineales de todos los orbitales atómicos de cada átomo de la molécula.
Combinaciones lineales de orbitales atómicos (LCAO)
Los orbitales moleculares fueron introducidos por primera vez por Friedrich Hund y Robert S. Mulliken en 1927 y 1928.
La combinación lineal de orbitales atómicos o aproximación "LCAO" para los orbitales moleculares fue introducida en 1929 por Sir John Lennard-Jones. Su innovador artículo mostró cómo derivar la estructura electrónica de las moléculas de flúor y oxígeno a partir de principios cuánticos. Este enfoque cualitativo de la teoría de los orbitales moleculares forma parte del inicio de la química cuántica moderna.
Las combinaciones lineales de orbitales atómicos (LCAO) pueden utilizarse para adivinar los orbitales moleculares que se forman cuando los átomos de la molécula se unen. De forma similar a un orbital atómico, también se puede construir una ecuación de Schrodinger, que describe el comportamiento de un electrón, para un orbital molecular. Las combinaciones lineales de orbitales atómicos, (las sumas y diferencias de las funciones de onda atómicas) proporcionan soluciones aproximadas a las ecuaciones de Schrodinger moleculares. Para las moléculas diatómicas simples, las funciones de onda que se obtienen están representadas matemáticamente por las ecuaciones
Ψ = ca ψa + cb ψb
y
Ψ* = ca ψa - cb ψb
donde Ψ y Ψ* son las funciones de onda moleculares para los orbitales moleculares de enlace y antienlace, respectivamente, ψa y ψb son las funciones de onda atómicas de los átomos a y b, respectivamente, y ca y cb son coeficientes ajustables. Estos coeficientes pueden ser positivos o negativos, dependiendo de las energías y simetrías de los orbitales atómicos individuales. A medida que los dos átomos se acercan, sus orbitales atómicos se solapan para producir zonas de alta densidad electrónica. Así, se forman orbitales moleculares entre los dos átomos. Los átomos se mantienen unidos por la atracción electrostática entre los núcleos cargados positivamente y los electrones cargados negativamente que ocupan los orbitales moleculares de enlace.
MOs enlazantes, antienlazantes y no enlazantes
Cuando los orbitales atómicos interactúan, el orbital molecular resultante puede ser de tres tipos: de enlace, de antienlace o de no enlace.
MOs de unión:
- Las interacciones de enlace entre los orbitales atómicos son interacciones constructivas (en fase).
- Los MOs de enlace son más bajos en energía que los orbitales atómicos que se combinan para producirlos.
MOs antibonding:
- Las interacciones antibonding entre orbitales atómicos son interacciones destructivas (fuera de fase).
- Los MOs antibonding son más altos en energía que los orbitales atómicos que se combinan para producirlos.
MOs no vinculantes:
- Las MO no vinculantes son el resultado de la no interacción entre los orbitales atómicos debido a la falta de simetrías compatibles.
- Los MOs sin enlace tendrán la misma energía que los orbitales atómicos de uno de los átomos de la molécula.
HOMO y LUMO
Cada orbital molecular tiene su propio nivel de energía. Los químicos clasifican los MO por niveles de energía. Los químicos suponen que los electrones llenarán primero los MO de menor nivel energético. Por ejemplo, si una molécula tiene electrones para llenar 15 orbitales, se llenarán las 15 MO con los niveles de energía más bajos. El 15º MO de la lista se llamaría "orbital molecular más ocupado" (HOMO) y el 16º MO de la lista sería el "orbital molecular más bajo desocupado" (LUMO). La diferencia entre el nivel de energía del HOMO y el nivel de energía del LUMO se denomina brecha de banda. La brecha de banda puede servir a veces como medida de la excitabilidad de la molécula: cuanto menor sea la energía, más fácilmente se excitará. Cuando el electrón es excitado, saltará a una MO desocupada. Por ejemplo, esto puede ayudar a adivinar si algo emitirá luz (luminiscencia).
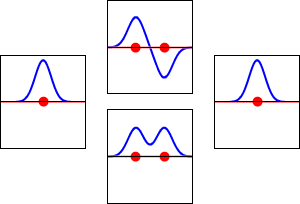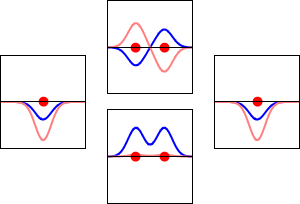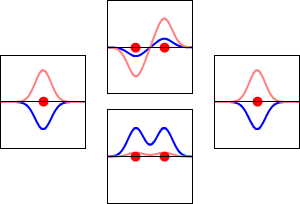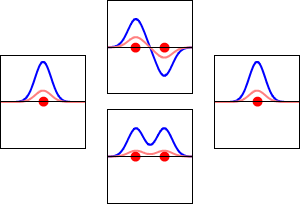
Funciones de onda de los electrones para el orbital 1s del átomo de hidrógeno (izquierda y derecha) y los correspondientes orbitales moleculares de enlace (abajo) y antienlace (arriba) de la molécula de H2 . La parte real de la función de onda es la curva azul y la parte imaginaria es la curva roja. Los puntos rojos marcan la ubicación de los protones. La función de onda del electrón oscila según la ecuación de onda de Schrödinger, y los orbitales son sus ondas estacionarias. La frecuencia de la onda estacionaria es proporcional a la energía del orbital. (Este gráfico es un corte unidimensional del sistema tridimensional).
Preguntas y respuestas
P: ¿Qué es un orbital molecular?
R: Un orbital molecular (o MO) es una función matemática que describe el comportamiento ondulatorio de un electrón en una molécula. Explica lo que ocurre con los electrones cuando los átomos se unen en una molécula y puede indicar la probabilidad de encontrar un electrón en cualquier región específica.
P: ¿Cómo construyen los químicos los modelos matemáticos de los orbitales moleculares?
R: Los químicos suelen construir modelos matemáticos de los orbitales moleculares combinando los orbitales atómicos. También se pueden utilizar orbitales híbridos de cada átomo de la molécula u otros orbitales moleculares de grupos de átomos. Los ordenadores pueden trabajar con estas funciones.
P: ¿Qué tiene que ver la mecánica cuántica con el estudio de las moléculas?
R: Los orbitales moleculares permiten a los químicos aplicar la mecánica cuántica al estudio de las moléculas. Responden a preguntas sobre cómo se adhieren los átomos de las moléculas y proporcionan información sobre las propiedades químicas y físicas.
P: ¿Qué son los diagramas orbitales?
R: Los diagramas orbitales son representaciones visuales que indican dónde se encontrarían probablemente los electrones en un átomo en función de sus diversas formas redondeadas.
P: ¿Cómo funcionan los orbitales híbridos?
R: Los orbitales híbridos combinan diferentes tipos de orbitales atómicos en un nuevo tipo que tiene características únicas en comparación con sus partes componentes. Estos híbridos se utilizan a menudo cuando se construyen modelos matemáticos para los orbitales moleculares.
P: ¿Cómo pueden ayudar los ordenadores a estudiar los MO?
R: Los ordenadores pueden ayudar a estudiar los MO trabajando en sus funciones y proporcionando predicciones o explicaciones más precisas de las propiedades químicas y físicas de las moléculas.
Buscar dentro de la enciclopedia