Química organometálica
La química organometálica es el estudio de los compuestos químicos que contienen enlaces entre el carbono y un metal. Combina aspectos de la química inorgánica (el estudio de los enlaces no carbónicos) y de la química orgánica (el estudio de los enlaces carbónicos).
Algunos ejemplos de compuestos organometálicos son el tetraetilo de plomo, que se utilizaba como aditivo para el combustible (gasolina con plomo) en el pasado. También la metilcobalamina (vitamina B12 ) es un compuesto organometálico común.
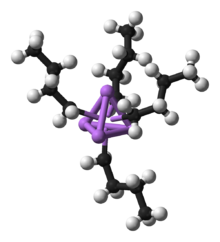
El n-butilitio , un compuesto organometálico. Cuatro átomos de litio se muestran en púrpura en un tetraedro, y cada átomo de litio está unido a un grupo butilo (el carbono es negro, el hidrógeno es blanco)
Compuestos organometálicos
Los compuestos organometálicos son compuestos que tienen enlaces químicos entre uno o más átomos de metal y uno o más átomos de carbono de un grupo organilo (un ligando orgánico). Llevan el prefijo "organo-" (por ejemplo, los compuestos de organopaladio). Los compuestos organometálicos incluyen subgrupos como las metaloproteínas, como la hemoglobina.
El término "metalorgánico" suele referirse a los compuestos que contienen metales y que carecen de enlaces directos metal-carbono, pero que contienen ligandos orgánicos que los unen a un compuesto orgánico. Los beta-diketonatos metálicos, los alcóxidos y las dialquilamidas son miembros de esta clase.
Además de los metales tradicionales, elementos como el boro, el silicio, el arsénico y el selenio forman compuestos organometálicos.
Compuestos de coordinación con ligandos orgánicos
Muchos complejos presentan enlaces de coordinación entre un metal y ligandos orgánicos. Los ligandos orgánicos suelen unirse al metal a través de un heteroátomo como el oxígeno o el nitrógeno, en cuyo caso estos compuestos se denominan "compuestos de coordinación".
En la naturaleza existen muchos compuestos orgánicos de coordinación. Por ejemplo, la hemoglobina y la mioglobina contienen un centro de hierro coordinado con los átomos de nitrógeno de un anillo de porfirina; el magnesio es el centro de un anillo de clorina en la clorofila. El campo de estos compuestos inorgánicos se conoce como química bioinorgánica. Sin embargo, la metilcobalamina (una forma de vitamina B12 ), con un enlace cobalto-metilo, es un verdadero complejo organometálico, uno de los pocos conocidos en biología.
Estructura y propiedades
El enlace metal-carbono en los compuestos organometálicos está a medio camino entre ser iónico y covalente. Los compuestos organometálicos con enlaces que tienen caracteres entre iónicos y covalentes son muy importantes en la industria. Ambos son relativamente estables en las soluciones, pero lo suficientemente iónicos como para sufrir reacciones. Dos clases importantes son los reactivos de organolitio y de Grignard.
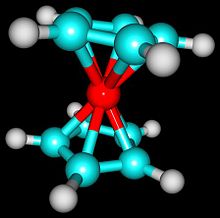
El metal Fe (rojo) une dos anillos orgánicos. En las estructuras de anillo, cada punto representa un átomo de carbono. Así, el ferroceno tiene 10 átomos de carbono, 5 en el anillo superior al hierro y 5 en el anillo inferior
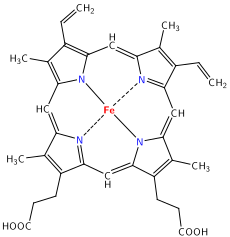
Grupo hemo de la hemoglobina
Utiliza
Los organometálicos encuentran usos prácticos en los procesos estequiométricos y catalíticos, especialmente en los procesos en los que interviene el monóxido de carbono y los polímeros derivados del alqueno. Todo el polietileno y el polipropileno del mundo se producen con catalizadores organometálicos. El ácido acético se produce con catalizadores metálicos de carbonilo en el proceso Monsanto y en el proceso Cativa. La mayor parte de los alcoholes sintéticos, al menos los mayores que el etanol, se producen por hidrogenación de aldehídos derivados de la hidroformilación. Del mismo modo, el proceso Wacker se utiliza en la oxidación del etileno a acetaldehído.
Los organometálicos son muy básicos y altamente reductores. Catalizan muchas reacciones de polimerización. También son útiles estequiométricamente.
Los compuestos organometálicos pueden encontrarse en el medio ambiente. Los ecologistas se preocupan por los compuestos orgánicos de plomo y mercurio. Son peligros tóxicos.
Actualmente se está investigando con la catálisis organometálica. La crisis energética ha suscitado un mayor interés por formas más eficientes de trabajar con los combustibles fósiles que nos quedan. Muchos están de acuerdo en que reducir la dependencia del petróleo es más seguro para el medio ambiente, además de políticamente sensato. El nuevo interés por las tecnologías "verdes" también ha contribuido a aumentar la investigación. Se pueden encontrar muchos ejemplos de investigación organometálica en las industrias petroquímica y farmacéutica. Algunos de los métodos actuales de producción de productos químicos son un derroche y producen residuos tóxicos, mientras que muchos catalizadores organometálicos son prometedores para cambiar esta situación.
Historia
Louis Claude Cadet sintetizó compuestos de arsénico metílico relacionados con el cacodilo. William Christopher Zeise creó el complejo de platino-etileno. Edward Frankland descubrió el dimetilcinc. Ludwig Mond descubrió el Ni(CO) 4. Victor Grignard trabajó con compuestos de organomagnesio. Los abundantes y diversos productos del carbón y del petróleo condujeron a la catálisis de Ziegler-Natta, Fischer-Tropsch e hidroformilación, que emplean CO, H 2, y alquenos como materias primas y ligandos.
Hace años, el tetraetilo de plomo se añadía a la gasolina como agente antidetonante. Como el plomo es tóxico, ya no se utiliza en la gasolina. En su lugar, ahora se añaden a la gasolina otros compuestos organometálicos como el ferroceno y el metilciclopentadienilo tricarbonilo de manganeso (MMT) para evitar el golpeteo.
Los premios Nobel concedidos en 1973 a Ernst Fischer y Geoffrey Wilkinson por sus trabajos sobre los metalocenos hicieron más popular la química organometálica. En 2005, Yves Chauvin, Robert H. Grubbs y Richard R. Schrock compartieron el Premio Nobel por la metátesis de olefinas catalizada por metales.
Cronología de la química organometálica
- 1760 Louis Claude Cadet de Gassicourt investiga las tintas a base de sales de cobalto y aísla el cacodilo a partir de un mineral de cobalto que contiene arsénico
- 1827 La sal de Zeise es el primer complejo platino / olefina
- 1848 Edward Frankland descubre el dietilzinc
- 1863 Charles Friedel y James Crafts preparan organoclorosilanos
- 1890 Ludwig Mond descubre el carbonilo de níquel
- 1899 Introducción de la reacción de Grignard
- 1900 Paul Sabatier trabaja en la hidrogenación de compuestos orgánicos con catalizadores metálicos. La hidrogenación de las grasas inicia los avances en la industria alimentaria, véase la margarina
- 1909 Paul Ehrlich introduce el Salvarsan para el tratamiento de la sífilis, un primer compuesto organometálico a base de arsénico
- 1912 Premio Nobel Victor Grignard y Paul Sabatier
- 1930 Henry Gilman trabaja en los cupratos de litio, véase el reactivo Gilman
- 1951 Se descubre el ferroceno
- 1963 Premio Nobel para Karl Ziegler y Giulio Natta sobre el catalizador Ziegler-Natta
- 1965 Descubrimiento del tricarbonilo de ciclobutadieno-hierro
- 1968 Reacción de Heck
- 1973 Premio Nobel Geoffrey Wilkinson y Ernst Otto Fischer sobre los compuestos sándwich
- 1981 Premio Nobel Roald Hoffmann y Kenichi Fukui sobre el Principio Isolobal
- Premio Nobel 2005 Yves Chauvin, Robert Grubbs y Richard R. Schrock sobre la metátesis de alquenos catalizada por metales
- Premio Nobel 2010 Richard F. Heck, Ei-ichi Negishi, Akira Suzuki por su trabajo en reacciones de acoplamiento catalizadas por paladio en síntesis orgánica.
Páginas relacionadas
- Quelación
Buscar dentro de la enciclopedia