Reacción SN2
La reacción S N2 (también conocida como sustitución nucleofílica bimolecular) es una reacción de sustitución en química orgánica. Es un tipo de sustitución nucleófila, en la que un par solitario de un nucleófilo ataca un centro electrófilo deficiente y se une a él. Esto expulsa a otro grupo llamado "grupo saliente". Así, el grupo entrante sustituye al grupo saliente en un solo paso. Dado que en el paso lento y determinante de la velocidad de la reacción intervienen dos especies reaccionantes, esto da lugar al nombre de sustitución nucleofílica bimolecular, o S N2. Entre los químicos inorgánicos, la reacción S 2 Nse conoce a menudo como mecanismo de intercambio.
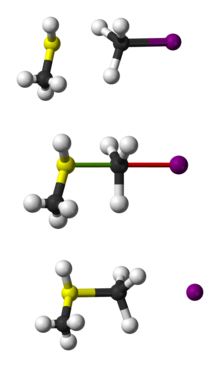
Representación de la reacción SN2 del CH 3SH con el CH 3I
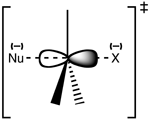
Estructura del estado de transición SN 2
Mecanismo de reacción
La reacción suele producirse en un centro de 3carbono alifático sp con un grupo emisor estable y electronegativo unido a él - "X"-, frecuentemente un átomo de haluro. La ruptura del enlace C-X y la formación del nuevo enlace C-Nu ocurren simultáneamente para formar un estado de transición en el que el carbono bajo ataque nucleofílico es pentacoordinado, y aproximadamente sp 2hibridado. El nucleófilo ataca el carbono a 180° del grupo saliente, ya que esto proporciona el mejor solapamiento entre el par solitario del nucleófilo y el orbital antienlace C-X σ*. El grupo saliente es entonces empujado hacia el lado opuesto y se forma el producto.
Si el sustrato bajo ataque nucleófilo es quiral, esto puede conducir, aunque no necesariamente, a una inversión de la estereoquímica, llamada inversión de Walden.
En un ejemplo de la reacción SN 2, el ataque del OH− (el nucleófilo) a un bromoetano (el electrófilo) da lugar a etanol, con el bromuro expulsado como grupo saliente:
Una reacción SN 2 se produce si la ruta de ataque por la parte posterior no está bloqueada por otros átomos de la molécula (obstaculizada estéricamente por los sustituyentes del sustrato). Por lo tanto, este mecanismo suele ocurrir en un centro de carbono primario sin obstáculos. Si hay un apiñamiento estérico en el sustrato cerca del grupo saliente, como en un centro de carbono terciario, la sustitución utilizará un mecanismo SN1 en lugar de S N2, (un SN 1 también sería más probable con moléculas bloqueadas porque se podría formar un intermediario de carbocación suficientemente estable).
En la química de coordinación, la sustitución asociativa procede por un mecanismo similar al del S N2.
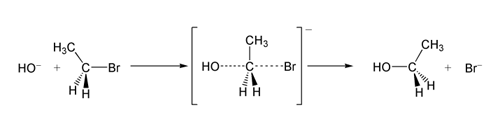
SN 2 reacción del bromoetano con el ion hidróxido.
Factores que afectan a la velocidad de la reacción
Cuatro factores afectan a la velocidad de la reacción:
- Sustrato. El sustrato desempeña el papel más importante en la determinación de la velocidad de la reacción. Esto se debe a que el nucleófilo ataca desde la parte posterior del sustrato, rompiendo así el enlace del grupo que deja el carbono y formando el enlace carbono-nucleófilo. Por lo tanto, para maximizar la velocidad de la reacción de S N2, la parte posterior del sustrato debe estar lo más libre posible. En general, esto significa que los sustratos metílicos y primarios son los que reaccionan más rápidamente, seguidos de los sustratos secundarios. Los sustratos terciarios no participan en las reacciones de S 2, debido al Nimpedimento estérico.
- Nucleófilo. Al igual que el sustrato, el impedimento estérico afecta a la fuerza del nucleófilo. El anión metóxido, por ejemplo, es a la vez una base fuerte y un nucleófilo porque es un nucleófilo de metilo, y por lo tanto está muy poco obstaculizado. El terc-butóxido, por el contrario, es una base fuerte, pero un mal nucleófilo, porque sus tres grupos metilo dificultan su aproximación al carbono. La fuerza del nucleófilo también se ve afectada por la carga y la electronegatividad: la nucleofilia aumenta con el aumento de la carga negativa y la disminución de la electronegatividad. Por ejemplo, el OH es -mejor nucleófilo que el agua, y el I -es mejor nucleófilo que el Br -(en disolventes próticos polares). En un disolvente aprótico polar, la nucleofilia aumenta en una columna de la tabla periódica, ya que no hay enlace de hidrógeno entre el disolvente y el nucleófilo. En este caso, la nucleofilia refleja la basicidad. Por tanto, el I -sería un nucleófilo más débil que el Br -porque es una base más débil.
- Disolvente. El disolvente afecta a la velocidad de reacción porque los disolventes pueden rodear o no a un nucleófilo, dificultando o no su aproximación al átomo de carbono. Los disolventes apróticos polares, como el tetrahidrofurano, son mejores disolventes para esta reacción que los disolventes próticos polares, porque los disolventes próticos polares serán disueltos por el enlace de hidrógeno del disolvente con el nucleófilo. Esto le impide atacar el carbono con el grupo saliente.
- Grupo saliente. El grupo saliente afecta a la velocidad de reacción. Cuanto más estable sea el grupo saliente, más probable será que tome los dos electrones de su enlace con el grupo saliente del carbono cuando el nucleófilo ataque al carbono. Por lo tanto, cuanto más débil sea el grupo saliente como base conjugada, mejor será el grupo saliente. Del mismo modo, cuanto más fuerte sea su ácido correspondiente, mejor será el grupo saliente. Ejemplos de buenos grupos salientes son los haluros (excepto el fluoruro) y el tosilato. Pero los HO -y los H 2N -no son buenos grupos salientes.
Cinética de la reacción
La velocidad de una reacción SN 2 es de segundo orden, ya que el paso que determina la velocidad depende de la concentración del nucleófilo, [Nu− ], así como de la concentración del sustrato, [RX].
r = k[RX][Nu−]
Esta es una diferencia clave entre los mecanismos S N1 y S N2. En la reacción S N1, el nucleófilo ataca después de que el paso limitante haya terminado. Pero en una reacción SN 2, el nucleófilo fuerza la salida del grupo saliente en el paso limitante. En otras palabras, la velocidad de las reacciones S N1 depende sólo de la concentración del sustrato, mientras que la velocidad de las reacciones SN 2 depende de la concentración tanto del sustrato como del nucleófilo. En los casos en los que ambos mecanismos son posibles (por ejemplo, en un centro de carbono secundario), el mecanismo depende del disolvente, la temperatura, la concentración del nucleófilo o del grupo saliente.
Las reacciones de SN 2 se favorecen generalmente en los haluros de alquilo primarios o secundarios con un disolvente aprótico. En los halogenuros de alquilo terciarios se producen a una velocidad insignificante debido al impedimento estérico.
S N2 y SN 1 son dos extremos de una escala móvil de reacciones. Es posible encontrar muchas reacciones que muestran tanto el carácter S N2 como el SN 1 en sus mecanismos. Por ejemplo, es posible obtener un par de iones de contacto formado a partir de un haluro de alquilo en el que los iones no están totalmente separados. Cuando éstos sufren una sustitución, la estereoquímica se invertirá (como en S 2N) para muchas de las moléculas que reaccionan, pero unas pocas pueden mostrar retención de la configuración. Las reacciones S N2 son más frecuentes que las S N1.
Concurso E2
Una reacción secundaria común que tiene lugar con las reacciones de SN 2 es la eliminación de E2: el anión entrante puede actuar como una base en lugar de como un nucleófilo, eliminando un protón y llevando a la formación del alqueno. Este efecto puede demostrarse en la reacción en fase gaseosa entre un sulfonato y un bromuro de alquilo simple que tiene lugar dentro de un espectrómetro de masas:

Con el bromuro de etilo, el producto de reacción es predominantemente el producto de sustitución. A medida que aumenta el impedimento estérico alrededor del centro electrofílico, como ocurre con el bromuro de isobutilo, la sustitución se ve desfavorecida y la eliminación es la reacción predominante. Otros factores que favorecen la eliminación son la fuerza de la base. Con el sustrato menos básico del benzoato, el bromuro de isopropilo reacciona con un 55% de sustitución. En general, las reacciones en fase gaseosa y en fase de disolución de este tipo siguen las mismas tendencias, aunque en la primera, los efectos del disolvente desaparecen.
Mecanismo de rotonda
Un avance que atrajo la atención en 2008 se refiere a un mecanismo de rodeo de SN 2 observado en una reacción en fase gaseosa entre iones de cloruro y yoduro de metilo con una técnica especial denominada imagen de haz molecular cruzado. Cuando los iones de cloruro tienen suficiente velocidad, la energía de los iones de yoduro resultantes después de la colisión es mucho menor de lo esperado, y se teoriza que la energía se pierde como resultado de un rodeo completo del grupo metilo alrededor del átomo de yodo antes de que se produzca el desplazamiento real.
Páginas relacionadas
- Reacción de sustitución
- S N1 reacción
Preguntas y respuestas
P: ¿Qué es la reacción SN2?
R: La reacción SN2 es una reacción de sustitución en química orgánica, en la que un nucleófilo ataca un centro electrófilo deficiente en electrones, expulsando un grupo saliente y sustituyéndolo después en un solo paso.
P: ¿Qué tipo de reacción de sustitución es la reacción SN2?
R: La reacción SN2 es un tipo de reacción de sustitución nucleofílica.
P: ¿Cuántas especies reaccionantes intervienen en el paso lento y determinante de la velocidad de la reacción SN2?
R: En el paso lento y determinante de la velocidad de la reacción SN2 intervienen dos especies reaccionantes.
P: ¿Qué significa el nombre "sustitución nucleofílica bimolecular" para la reacción SN2?
R: El nombre "sustitución nucleofílica bimolecular" para la reacción SN2 hace referencia al hecho de que dos especies reaccionantes participan en el paso lento y determinante de la velocidad de la reacción.
P: ¿Qué es un nucleófilo en el contexto de la reacción SN2?
R: Un nucleófilo es una molécula o ion que dona un par solitario de electrones para formar un enlace químico.
P: ¿Qué es un electrófilo en el contexto de la reacción SN2?
R: Un electrófilo es una molécula o ion que acepta un par de electrones para formar un enlace químico.
P: ¿Cómo se conoce a menudo la reacción SN2 entre los químicos inorgánicos?
R: Entre los químicos inorgánicos, la reacción SN2 se conoce a menudo como mecanismo de intercambio.
Buscar dentro de la enciclopedia