Estado de transición (química): definición, energía de activación y mecanismos
Estado de transición (química): qué es, energía de activación, diferencias con intermedios y su papel en mecanismos y cinética; métodos y teorías para su estudio.
En una reacción química, el estado de transición es el punto de mayor energía a lo largo del recorrido que siguen los reactivos hasta convertirse en productos. Esta energía máxima se relaciona con la llamada energía de activación, que es la barrera energética que deben superar las especies reactivas para que la reacción ocurra. En un diagrama de perfil energético la transición aparece como un pico y se suele marcar con el símbolo de la doble daga ‡.
Características del estado de transición
El estado de transición no es una especie aislable: representa una geometría y un arreglo electrónico particulares en los que hay enlaces formándose y rompiéndose simultáneamente. Algunas características clave:
- Es un máximo de energía a lo largo de la coordenada de reacción (no un mínimo), por eso no puede aislarse.
- Tiene una vida extremadamente corta, típicamente del orden de femtosegundos (10−15 s) o menos.
- Presenta estructuras con enlaces parcialmente formados y roturas parciales de enlaces antiguos; sus energías y geometrías son intermedias entre reactivos y productos.
- Se representa con frecuencia con la notación ‡ tras el nombre (por ejemplo, “TS‡”).
Distinción entre estado de transición e intermedio
Es importante no confundir los estados de transición con los intermedios. Los intermedios corresponden a mínimos de energía en el perfil de reacción y pueden ser especies que vivan lo suficiente como para detectarse o aislarse; en cambio, el estado de transición está en un máximo de energía y nunca se aísla. Ambos, sin embargo, se sitúan entre los reactivos y los productos en el mecanismo de reacción.
Energía de activación y relación con la velocidad
La altura del máximo energético determina la tasa de la reacción: cuanto mayor es la barrera (mayor energía de activación), más lenta es la reacción a una temperatura dada. La teoría del estado de transición relaciona la energía libre de activación (ΔG‡) con la constante de velocidad mediante la ecuación de Eyring:
k = (k_B T / h) · e^(−ΔG‡/RT)
donde k es la constante de velocidad, k_B la constante de Boltzmann, h la constante de Planck, T la temperatura y R la constante de los gases. La energía de activación puede descomponerse en términos entálpicos y entrópicos (ΔH‡ y ΔS‡), lo que ayuda a entender si la barrera es principalmente energética o si hay efectos entropía que la modifiquen.
Mecanismos, postulado de Hammond y catalizadores
El estudio del estado de transición es clave para comprender los mecanismos de reacción. El postulado de Hammond ofrece una regla empírica: el estado de transición tenderá a parecerse estructuralmente al compuesto (reactivo o producto) que esté más próximo en energía. Esto ayuda a inferir si el TS tiene carácter más “reactivo” o más “producto”.
Los catalizadores aceleran las reacciones al estabilizar el estado de transición (es decir, reducir ΔG‡), o bien proporcionando una vía alternativa con un estado de transición de menor energía. Enzimáticamente, la estabilización del TS es un principio central para la catálisis biológica.
Cómo se estudia el estado de transición
Debido a su naturaleza transitoria, el estado de transición es difícil de observar directamente, pero puede investigarse mediante:
- Computación química: métodos de mecánica cuántica (DFT, métodos ab initio) permiten localizar geométricamente un punto de máximo (un TS) y seguir la Intrinsic Reaction Coordinate (IRC) para comprobar que conecta reactivos y productos.
- Efectos isotópicos cinéticos (KIE): el cambio en la velocidad al sustituir átomos por sus isótopos aporta información sobre qué enlaces se están rompiendo o formando en el TS.
- Espectroscopias ultrarrápidas: técnicas pump–probe y espectroscopía infrarroja femtosegundo pueden captar señales asociadas a estados transitorios en reacciones muy rápidas.
- Análisis cinético y relaciones lineales de energía libre: estudios experimentales y correlaciones (p. ej. relaciones de Hammett) permiten inferir características del TS.
Importancia práctica
Conocer la naturaleza del estado de transición tiene aplicaciones prácticas importantes: diseño de catalizadores y fármacos (inhibidores que imitan la estructura del TS), optimización de condiciones de reacción en síntesis orgánica, comprensión de reacciones enzimáticas y predicción de selectividades (regio-, óreo- y estereoselectividad) basadas en diferencias energéticas entre distintos estados de transición posibles.
Resumen
El estado de transición es el punto de máxima energía en una reacción, clave para determinar la velocidad y el mecanismo. No es aislable y existe solo transitoriamente, pero puede estudiarse mediante técnicas experimentales avanzadas y métodos computacionales. La comprensión y el control del TS permiten diseñar mejores catalizadores y predecir comportamientos en reacciones químicas.
En definitiva, el estudio de los estados de transición forma parte fundamental de la cinética química y de la investigación que busca dominar y optimizar reacciones químicas.
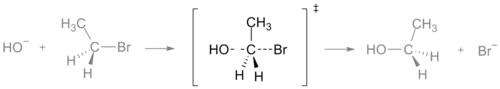
El estado de transición de una reacción SN2
Buscar dentro de la enciclopedia