Energía de activación: qué es, definición y cómo se mide
Energía de activación: qué es, definición y cómo medirla (Ea en kJ/mol). Aprende su papel como barrera en reacciones químicas y métodos para calcularla.
La energía de activación de una reacción química es la energía mínima que deben aportar los reactivos para iniciar la transformación hacia productos. Suele representarse por Ea y se expresa en kilojulios por mol (kJ·mol-1) o en julios por mol (J·mol-1). Físicamente puede entenderse como una barrera energética entre los reactivos y los productos: la estado de transición (o complejo activado) se sitúa a una energía mayor que la de los reactivos, y Ea es la diferencia de energía entre ese estado de transición y los reactivos de partida.
Significado físico y diagrama de energía
En un diagrama de coordenada de reacción (energía vs. coordenada de reacción), la energía de activación corresponde a la altura del pico que separa el valle de los reactivos y el valle de los productos. Cuanto mayor es Ea, menor suele ser la fracción de moléculas con energía suficiente para reaccionar a una temperatura dada, y por tanto más lenta la reacción. La energía de activación no es la energía total liberada o absorbida por la reacción (esa es la entalpía de reacción), sino la barrera que hay que superar para que la reacción ocurra.
Dependencia con la temperatura y la ecuación de Arrhenius
La dependencia de la velocidad de reacción con la temperatura se describe frecuentemente con la ecuación de Arrhenius:
k = A · e-Ea/(RT)
donde k es la constante de velocidad, A es el factor preexponencial (o frecuencia efectiva de colisiones/orientaciones correctas), R es la constante de los gases (8,314 J·mol-1·K-1) y T la temperatura absoluta en kelvin. Tomando logaritmos naturales se obtiene:
ln k = ln A − Ea/(R T)
Si se grafica ln k frente a 1/T se obtiene una recta cuya pendiente es −Ea/R; a partir de esa pendiente se puede calcular Ea (Ea = −pendiente·R).
Cómo se mide experimentalmente
- Medición de constantes de velocidad: se determina la constante de velocidad k a varias temperaturas y se aplica la ecuación de Arrhenius (gráfica ln k vs. 1/T) para obtener Ea.
- Teoría del estado de transición (Eyring): usando la ecuación de Eyring, k = (kBT/h)·e-ΔG‡/(RT), es posible obtener la energía (entalpía) de activación ΔH‡ y la entropía de activación ΔS‡ a partir de la dependencia con la temperatura; ΔG‡ = ΔH‡ − TΔS‡. La Eyring proporciona información termodinámica más completa del estado de transición.
- Espectroscopía y cálculos teóricos: métodos espectroscópicos (ultrarrápidos) y cálculos de química computacional permiten identificar y estimar la energía del estado de transición en reacciones elementales.
Relación con la entalpía y la energía libre de activación
La Ea obtenida por Arrhenius es una cantidad cinética que, en muchos casos, se relaciona con la entalpía de activación ΔH‡ de la teoría del estado de transición. Aproximadamente se suele usar la relación Ea ≈ ΔH‡ + RT (para reacciones elementales, con T en la escala donde se mida). La energía libre de activación ΔG‡ condiciona la constante de velocidad a través de la ecuación de Eyring: cuanto mayor ΔG‡, más lenta la reacción a esa temperatura.
Catalizadores y modificación de Ea
Los catalizadores aceleran las reacciones al proporcionar una ruta alternativa con un menor Ea. No cambian la energía de los reactivos ni la de los productos en la reacción global, pero sí reducen la altura de la barrera (o introducen varios pasos con barreras menores), aumentando la fracción de colisiones eficaces y, por tanto, la velocidad.
Valores típicos y casos especiales
- Valores típicos de Ea varían ampliamente: reacciones rápidas en fase líquida o enzimáticas pueden tener Ea del orden de 10–50 kJ·mol-1, mientras que muchas reacciones en fase gaseosa o romper enlaces fuertes requieren 100–400 kJ·mol-1.
- A veces se observa una Ea aparente negativa: esto no significa que no exista barrera física, sino que la cinética está dominada por equilibrios previos o mecanismos complejos que producen una disminución aparente de k con T en el intervalo estudiado.
- En procesos controlados por difusión, la dependencia con la temperatura puede ser débil y la Ea aparente cercana a cero.
Resumen práctico
- La energía de activación Ea indica la barrera energética que deben superar los reactivos para reaccionar.
- Se mide en J·mol-1 o kJ·mol-1 y afecta fuertemente la velocidad con la temperatura.
- Se determina experimentalmente mediante la dependencia de la constante de velocidad con la temperatura (gráfica de Arrhenius) o con la teoría del estado de transición (Eyring).
- Los catalizadores disminuyen Ea y aceleran las reacciones sin alterar la energía global de reactivos y productos.
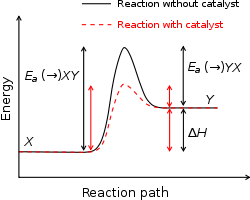
Energía de activación con y sin catalizador
Ecuación de Arrhenius
Esta ecuación es una forma de calcular la energía de activación. Su forma es:
k = A e - E a / R T {\displaystyle k=Ae^{-E_{a}}/{RT}}
Aquí, k es la constante de velocidad de la reacción (que puede medirse utilizando la cinética química), A es un factor de frecuencia, R es la constante universal de los gases, T es la temperatura. Si medimos la velocidad de la reacción a diferentes temperaturas, podemos hacer un gráfico y calcular la energía de activación utilizando esta ecuación.
Catálisis
Cuando se utiliza un catalizador, la energía de activación se reduce. Esto significa que la reacción puede ser más rápida a la misma temperatura. El catalizador no cambia la energía de los reactivos ni de los productos. Además, el catalizador no cambia en la reacción. Por lo tanto, puede utilizarse una y otra vez y sólo se necesita una pequeña cantidad de catalizador.
Buscar dentro de la enciclopedia
