Mecanismo de reacción química: definición, pasos, intermedios y tipos
Descubre el mecanismo de reacción química: definición, pasos, intermedios y tipos. Aprende cómo se mueven electrones y qué enlaces se forman o rompen.
Un mecanismo de reacción consiste en describir paso a paso cómo se lleva a cabo una reacción química. Normalmente, sólo se observa el cambio global; los eventos intermedios en la ruta reaccionan tan rápidamente que no son visibles a simple vista. Estas especies temporales se llaman intermedios, y al pasar de un intermedio a otro se atraviesa un estado de transición. Entender todos los pasos que componen el cambio total es esencial para predecir productos, optimizar condiciones, diseñar catalizadores y en general controlar una reacción para que ocurra de la manera deseada.
Pasos elementales y conceptos clave
- Paso elemental: cada etapa simple en la que se rompen o forman enlaces; suele representarse por una ecuación química simple y puede corresponder a un único evento molecular.
- Molecularidad: indica cuántas moléculas participan en un paso (unimolecular, bimolecular, termolecular). La molecularidad condiciona la ley de velocidad del paso elemental.
- Paso determinante de la velocidad (RDS): el paso más lento de la secuencia que controla la velocidad global de la reacción. La energía de activación asociada al RDS suele aparecer como la cumbre más alta en un diagrama de energía.
- Estado de transición vs intermedio: el estado de transición es un máximo de energía en la coordenada de reacción y no puede aislarse; un intermedio es un mínimo relativo que, en algunos casos, puede detectarse o atraparse experimentalmente.
- Perfil energético (diagrama de coordenada de reacción): representa la energía frente al progreso de la reacción e ilustra barreras de activación, intermedios y la energía global del proceso.
Tipos de intermedios comunes
- Carbocationes: especies con carga positiva sobre carbono (comunes en mecanismos como sustitución nucleófila unimolecular —SN1— y en algunas eliminaciones).
- Carbaniones: carbono con carga negativa, frecuentes en reacciones de adición y en pasos nucleofílicos.
- Radicales: especies con electrones desapareados, típicas de reacciones en cadena y procesos fotoquímicos.
- Carbenos y carbinos: intermediarios neutros con una valencia no satisfecha; participan en inserciones y reacciones de adición especiales.
Tipos de mecanismos (resumen y diferencias)
- En química orgánica: los más comunes son la sustitución nucleófila, la eliminación y la adición. Cada uno puede ocurrir por vías diferentes:
- SN1 vs SN2: SN1 es un proceso en dos pasos con formación de un carbocatión (intermedio); la velocidad depende sólo del sustrato (unimolecular). SN2 es un proceso concertado (un solo paso bimolecular) donde el nucleófilo ataca mientras el grupo sale.
- E1 vs E2: E1 es eliminación unimolecular vía carbocatión; E2 es eliminación concertada bimolecular (protón y grupo saliente interactúan en el mismo paso).
- Adiciones: pueden ser electrofílicas, nucleofílicas o radicalarias, y pueden ser concertadas o paso a paso.
- Mecanismos radicalarios: iniciación, propagación y terminación (reacciones en cadena; p. ej. halogenación radicalaria de alcanos).
- Pericíclicas: reacciones concertadas que siguen reglas de orbitales (p. ej. reacciones de Diels–Alder, electrociclos).
- Redox y transferencia de electrones: implican cambios en los estados de oxidación y a menudo pasan por complejos de transferencia de electrones simples o por pasos con radicales libre.
- Acido-base y tautomerizaciones: intercambios rápidos de protones que a veces son pasos preliminares en mecanismos más complejos.
- Catalíticos y enzimáticos: los catalizadores (incluyendo enzimas) proporcionan rutas alternativas con barreras menores y pueden estabilizar intermedios o estados de transición específicos.
Representación de movimientos electrónicos
En química orgánica se utiliza con frecuencia el empuje de flechas para mostrar cómo se mueve la densidad electrónica: las flechas curvas indican el desplazamiento de pares de electrones desde un donador (nucleófilo o enlace) hacia un aceptador (electrófilo o átomo con deficiencia electrónica). Esto permite visualizar claramente qué enlaces se rompen y cuáles se forman durante cada paso, y facilita distinguir si un paso es concertado o paso a paso.
Métodos para estudiar mecanismos
- Cinetica química: determinación de leyes de velocidad y órdenes de reacción para identificar pasos elementales y el RDS.
- Etiquetado isotópico: usar isótopos (D, 13C, 18O) para seguir la trayectoria de átomos y detectar intercambio o reposicionamiento.
- Atrapar intermedios: con reactivos que formen productos caracterizables si un intermedio está presente (trampas de radicales, bases o nucleófilos que capturan carbocationes, etc.).
- Espectroscopía y técnicas rápidas: espectroscopía ultrarrápida, RMN, espectrometría de masas y crio-techniques pueden detectar intermedios de vida corta.
- Química computacional: cálculo de perfiles de energía, estructuras de estados de transición e identificación de rutas preferentes mediante métodos teóricos.
Factores que afectan el mecanismo
- Solvente: polar protico vs aprótico afecta estabilidad de iones y por tanto favorece SN1/SN2 o E1/E2.
- Temperatura y presión: influyen en las velocidades y en la posición del equilibrio; algunas rutas requieren energía térmica o fotónica.
- Concentración y fuerza iónica: pueden cambiar la velocidad de pasos bimoleculares y la estabilidad de especies cargadas.
- Catalizadores: ácidos, bases, metales de transición y enzimas alteran la energía de activación y pueden cambiar el mecanismo dominante.
Resumen práctico
Un mecanismo de reacción describe la secuencia de pasos elementales entre reactivos y productos, incluyendo intermedios y estados de transición. Identificar la molecularidad de cada paso, el paso determinante de la velocidad y el tipo de intermedios ayuda a controlar la reacción y a diseñar condiciones óptimas. Herramientas experimentales (cinética, etiquetado isotópico, trampas, espectroscopía) y computacionales se combinan para proponer y verificar mecanismos. En química orgánica, conceptos como SN1/SN2, E1/E2 y adiciones son ejemplos claros de cómo pequeños cambios en condiciones o estructura del sustrato pueden cambiar radicalmente la ruta seguida.
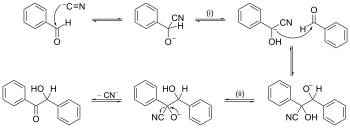
Un ejemplo de mecanismo de reacción con empuje de flecha
Preguntas y respuestas
P: ¿Qué es un mecanismo de reacción?
R: Un mecanismo de reacción es una explicación paso a paso de cómo funciona una reacción química.
P: ¿Por qué es importante comprender todos los pasos de un mecanismo de reacción?
R: Es importante comprender todos los pasos de un mecanismo de reacción para entender reacciones difíciles o intentar que una reacción funcione de una determinada manera.
P: ¿Qué son los intermediarios en una reacción química?
R: Los productos intermedios son las cosas que se producen entre reacciones demasiado rápidas para ser vistas en una reacción química.
P: ¿Qué es un estado de transición en una reacción química?
R: Un estado de transición se cruza al pasar de un intermediario a otro durante una reacción química.
P: ¿Cuáles son los tipos más comunes de mecanismos de reacción en química orgánica?
R: Los tipos más comunes de mecanismos de reacción en química orgánica son la sustitución nucleofílica, la eliminación y la adición.
P: ¿Qué es el empuje de flecha en un mecanismo de reacción química?
R: El empuje de flechas se utiliza a veces para dibujar cómo se mueven los electrones durante una reacción. Esto facilita ver qué enlaces se forman y cuáles se rompen durante el proceso.
P: ¿Qué información puede obtenerse de la comprensión de un mecanismo de reacción?
R: Comprender un mecanismo de reacción puede proporcionar información sobre cómo hacer que una reacción funcione de la forma deseada o para entender reacciones más difíciles.
Buscar dentro de la enciclopedia