Carbocatión: definición, estructura y reactividad del ion de carbono
Carbocatión: descubre su definición, estructura planar y reactividad del ion de carbono; explicación clara de estabilidad, hibridación y mecanismos reactivos.
Un carbocatión es un ion con un átomo de carbono cargado positivamente. El átomo de carbono cargado en un carbocatión tiene normalmente un "sexteto" —es decir, sólo dispone de seis electrones en su capa de valencia exterior en lugar de los ocho que marca la regla del octeto. Debido a esa deficiencia electrónica y a la presencia de una carga formal positiva, los carbocationes son especies altamente reactivas y buscan recuperar estabilidad electrónica, por ejemplo mediante ataques nucleofílicos o reordenamientos internos.
Estructura y hibridación
Aunque la lógica elemental podría sugerir que un carbocatión tiene un 3 orbital sp3 vacío que acumula la carga positiva, la evidencia experimental y teórica muestra que la hibridación más consistente con su geometría es 2 sp2. En la práctica, un carbocatión "clásico" presenta:
- Geometría planar trigonal: los tres sustituyentes enlazados al carbono cargado y los orbitales sp2 ocupados están en un mismo plano.
- Orbital p vacío: perpendicular al plano, existe un orbital p no ocupado que contiene la carga positiva parcial y acepta densidad electrónica de nucleófilos o de sustituyentes vecinos (por resonancia o hiperconjugación).
Factores que estabilizan o desestabilizan
La estabilidad relativa de un carbocatión depende de varios efectos que pueden aumentar o disminuir la carga positiva en el carbono:
- Hiperconjugación: los enlaces C–H y C–C de los grupos vecinos pueden donar densidad al orbital p vacío, estabilizando el carbocatión. Por eso: terciario > secundario > primario.
- Efecto inductivo: grupos alquilo liberadores de electrones (efecto +I) estabilizan; sustituyentes electronegativos lo desestabilizan.
- Resonancia (mesomería): carbocationes benzílicos o alílicos se estabilizan cuando la carga puede delocalizarse sobre un sistema π (por ejemplo, el carbocatión benzílico o el alílico).
- Solvatación: disolventes polares y nucleófilos (p. ej. agua, alcoholes) estabilizan carbocationes por interacción electrostática y formación de complejos soluto–solvente.
- Carbocationes no clásicos: en algunos sistemas (p. ej. el ion bridgado 2-norbornilio) la carga está deslocalizada sobre varios centros mediante enlaces puente, lo que puede conferir estabilidad o propiedades reactivas atípicas.
Tipos de carbocationes
- Primario, secundario, terciario: según el número de grupos alquilo unidos al carbono cargado; la estabilidad aumenta con el número de grupos alquilo.
- Benzylico y alílico: especialmente estables por resonancia.
- Aromáticos carbocatiónicos especiales: por ejemplo, el catión tropilio (tropylium) es aromático y notablemente estable.
Formación y reactividad típica
Los carbocationes se forman por varios procesos comunes en síntesis orgánica:
- Heterólisis de enlaces C–X: ruptura heterolítica de un enlace carbono–halógeno o carbono–oxígeno (p. ej. ionización en reacciones SN1 o en solvolisis) genera un carbocatión.
- Protonación de dobles enlaces: al protonar un alqueno se genera un carbocatión intermedio que puede ser capturado por nucleófilos.
- Eliminación y rearrangements: en mecanismos E1 y en muchas reacciones ácido-catalizadas aparecen carbocationes como intermediarios.
Una vez formados, los carbocationes pueden sufrir:
- Ataque nucleofílico: reacción rápida con nucleófilos (iones, solventes, aniones) para formar nuevos enlaces C–X o C–C.
- Eliminación: pérdida de un protón vecino para dar alqueno (E1).
- Reordenamientos (rearrangements): desplazamientos de hidruro o de grupos alquilo hacia el centro carbocatiónico pueden producir carbocationes más estables y explicar productos inesperados en reacciones.
Ejemplos y aplicaciones
Los carbocationes son intermediarios claves en numerosas reacciones orgánicas: reacciones de alquilación (Friedel–Crafts), hidraciones ácido-catalizadas, eliminación E1, y procesos en bioquímica (por ejemplo, algunas enzimas generan intermedios semejantes a carbocationes durante la biosíntesis de terpenos). Además, el estudio de carbocationes ha llevado a la identificación de especies especiales como el catión tropilio y a la caracterización de carbocationes no clásicos.
Detección y vida media
La existencia de carbocationes ha sido confirmada por métodos experimentales como espectroscopía (NMR en matrices frías, espectroscopía ultravioleta), métodos de captura con nucleófilos y técnicas de espectrometría de masas. En solución, su vida media depende de su estabilidad y de las condiciones (disolvente, temperatura, presencia de nucleófilos); muchos son transitorios y reaccionan en tiempos extremadamente cortos, aunque algunos carbocationes estabilizados pueden detectarse y caracterizarse directamente.
Resumen: un carbocatión es un ion carbono con carga positiva, típicamente con hibridación sp2 y un orbital p vacío que favorece una geometría planar trigonal; su reactividad y estabilidad están determinadas por hiperconjugación, efectos inductivos, resonancia y solvatación, y juegan un papel central en multitud de reacciones orgánicas.
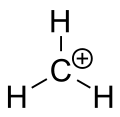
Ion carbenio del metano

catión tert-butílico, demostrando una geometría planar
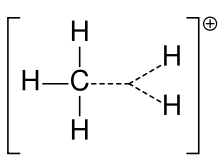
Ion carbonio del metano
Definiciones
Anteriormente, un carbocatión se denominaba a menudo ion carbonio, pero los químicos cuestionan su significado exacto. En la química actual, un carbocation es cualquier átomo de carbono con carga positiva. Se han sugerido dos tipos especiales: los iones carbenium son trivalentes y los iones carbonium son pentavalentes o hexavalentes. Los libros de texto de nivel universitario sólo hablan de los carbocationes como si fueran iones de carbenio, o hablan de los carbocationes con una referencia fugaz a la frase más antigua de ion de carbonio o iones de carbenio y carbonio. Un libro de texto sigue utilizando el nombre antiguo de ion carbonio para el ion carbenio y reserva la frase ion carbenio hipervalente para el CH 5+.
Historia
En 1891, G. Merling informó que añadió bromo al tropilideno (cicloheptatrieno) y luego calentó el producto para obtener un material cristalino y soluble en agua, C
7H
7Br. No sugirió una estructura para él; sin embargo, Doering y Knox demostraron de forma convincente que se trataba de bromuro de tropilideno (cicloheptatrienio). La regla de Hückel predice que este ion es aromático.
En 1902, Norris y Kehrman descubrieron de forma independiente que el trifenilmetanol incoloro daba soluciones de color amarillo intenso en ácido sulfúrico concentrado. El cloruro de trifenilmetilo formaba igualmente complejos anaranjados con cloruros de aluminio y estaño. En 1902, Adolf von Baeyer reconoció el carácter salino de los compuestos formados.

Llamó a la relación entre el color y la formación de la sal halochromy de la cual el verde de malaquita es un ejemplo principal.
Los carbocationes son intermediarios reactivos en muchas reacciones orgánicas. Esta idea, propuesta por primera vez por Julius Stieglitz en 1899, fue desarrollada por Hans Meerwein en su estudio de 1922 sobre el reordenamiento Wagner-Meerwein. También se descubrió que los carbocationes estaban implicados en la reacción SN1, la reacción E1 y en reacciones de reordenación como el desplazamiento Whitmore 1,2. El sector químico era reacio a aceptar la noción de carbocación y durante mucho tiempo el Journal of the American Chemical Society rechazó los artículos que los mencionaban.
El primer espectro de RMN de un carbocatión estable en solución fue publicado por Doering et al. en 1958. Se trataba del ion heptametilbenceno, obtenido al tratar el hexametilbenceno con cloruro de metilo y cloruro de aluminio. El catión estable 7-norbornadienilo fue preparado por Story et al. en 1960 haciendo reaccionar cloruro de norbornadienilo con tetrafluoroborato de plata en dióxido de azufre a -80 °C. El espectro de RMN estableció que se trataba de un ion no clásico (el primer ion estable no clásico observado).
En 1962, Olah observó directamente el carbocatión terc-butilo por resonancia magnética nuclear como una especie estable al disolver fluoruro de terc-butilo en ácido mágico. La RMN del catión norbornilo fue comunicada por primera vez por Schleyer et al. y se demostró que sufría una agitación de protones sobre una barrera por Saunders et al.
Propiedades
En química orgánica, un carbocatión es a menudo el objetivo de un ataque nucleofílico por parte de nucleófilos como los iones hidroxilo (OH −) o los iones halógenos.
Los carbocationes se clasifican como primarios, secundarios o terciarios en función del número de átomos de carbono unidos al carbono ionizado. Los carbocationes primarios tienen uno o cero carbonos unidos al carbono ionizado, los secundarios tienen dos carbonos unidos al carbono ionizado y los terciarios tienen tres carbonos unidos al carbono ionizado.
La estabilidad del carbocatión aumenta con el número de grupos alquilo unidos al carbono portador de carga. Los carbocationes terciarios son más estables (y se forman más fácilmente) que los carbocationes secundarios; los carbocationes primarios son muy inestables porque, mientras que los carbonos ionizados de orden superior se estabilizan por hiperconjugación, los carbonos no sustituidos (primarios) no lo están. Por lo tanto, reacciones como la reacciónSN1 y la reacción de eliminación E1 normalmente no ocurren si se formaría un carbocatión primario. Una excepción a esto ocurre cuando hay un doble enlace carbono-carbono junto al carbono ionizado. Tales cationes como el catión alílico CH 2=CH-CH 2+y el catión bencílico C 6H 5-CH 2+son más estables que la mayoría de los demás carbocationes. Las moléculas que pueden formar carbocationes alílicos o bencílicos son especialmente reactivas.
Los carbocationes sufren reacciones de reordenación desde estructuras menos estables a otras igualmente estables o más estables con constantes de velocidad superiores a 10 9/seg. Este hecho complica las vías de síntesis de muchos compuestos. Por ejemplo, cuando el 3-pentanol se calienta con HCl acuoso, el carbocatión 3-pentilo formado inicialmente se reordena a una mezcla estadística del 3-pentilo y el 2-pentilo. Estos cationes reaccionan con el ion cloruro para producir aproximadamente 1/3 de 3-cloropentano y 2/3 de 2-cloropentano.
Algunos carbocationes, como el catión norbornilo, presentan un enlace de tres centros más o menos simétrico. Los cationes de este tipo se denominan iones no clásicos. La diferencia de energía entre los carbocationes "clásicos" y los isómeros "no clásicos" suele ser muy pequeña y, por lo general, la energía de activación implicada en la transición entre las estructuras "clásicas" y "no clásicas" es escasa o nula. La forma "no clásica" del carbocatión de 2-butilo es esencialmente 2-buteno con un protón directamente encima del centro de lo que sería el doble enlace carbono-carbono. Los carbocationes "no clásicos" fueron en su día objeto de gran controversia. Una de las mayores contribuciones de George Olah a la química fue la resolución de esta controversia.
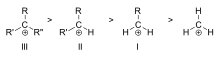
Orden de estabilidad de ejemplos de carbocationes alquílicos terciarios (III), secundarios (II) y primarios (I)
Carbocationes específicos
Los cationes de ciclopropilcarbinilo pueden ser estudiados por RMN:

En el espectro de RMN de un derivado dimetílico, se encuentran dos señales no equivalentes para los dos grupos metilo, lo que indica que la conformación molecular de este catión no es perpendicular (como en A), sino bisecada (como en B), con el orbital p vacío y el sistema de anillos de ciclopropilo en el mismo plano:

En términos de la teoría de los enlaces doblados, esta preferencia se explica asumiendo un solapamiento orbital favorable entre los enlaces doblados del ciclopropano lleno y el orbital p vacío.
Preguntas y respuestas
P: ¿Qué es un carbocatión?
R: Un carbocatión es un ion con un átomo de carbono cargado positivamente.
P: ¿Cuál es la capa de valencia externa de un carbocatión?
R: La capa de valencia externa de un carbocatión sólo tiene seis electrones en lugar de los ocho electrones de valencia estables.
P: ¿Por qué los carbocationes suelen ser reactivos?
R: Los carbocationes suelen ser reactivos porque buscan llenar el octeto de electrones de valencia así como recuperar una carga neutra.
P: ¿Cuál es la estabilidad máxima para los átomos de carbono?
R: La máxima estabilidad para los átomos de carbono se alcanza cuando tienen ocho electrones de valencia.
P: ¿Qué es un sexteto en química?
R: Un sexteto es un término utilizado para describir un átomo de carbono en un carbocatión que sólo tiene seis electrones en su capa de valencia externa en lugar de los ocho electrones de valencia estables.
P: ¿Cuál es la hibridación y la geometría molecular de un carbocatión?
R: Aunque la lógica sugeriría que los carbocationes tienen hibridación sp3 con un orbital sp3 vacío que da una carga positiva, su reactividad se asemeja más a la hibridación sp2 con una geometría molecular planar trigonal.
P: ¿Qué es la regla del octeto?
R: La regla del octeto es un principio de la química que establece que los átomos tienden a formar enlaces químicos con otros átomos que permiten que ambos átomos tengan un conjunto estable de ocho electrones de valencia.
Buscar dentro de la enciclopedia