Electrófilo (química): qué es, ejemplos y reactividad
Electrófilo en química: definición, ejemplos (HCl, carbonilos), mecanismos y reactividad frente a nucleófilos. Guía clara y práctica para estudiantes y profesionales.
En química, un electrófilo es una molécula o un átomo que acepta electrones procedentes de otra especie. Muchos electrófilos tienen una carga positiva y, por ello, también se denominan ácidos de Lewis. Otros son neutros pero presentan enlaces polarizados o átomos con orbitales vacíos que los hacen pobres en electrones y, por tanto, reactivos hacia donantes electrónicos.
Tipos y ejemplos de electrófilos
- Cationes: protones (H+), carbocationes (R–C+–R), iones acilio. Estas especies son fuertemente electrófilas por su carga positiva.
- Moléculas polarizadas: compuestos con enlaces muy polarizados por diferencias de electronegatividad, como el HCl o los carbonilos (carbonilo, e.g., aldehídos y cetonas). En estos casos el átomo parcialmente positivo (por ejemplo, el carbono carbonílico) actúa como electrófilo.
- Electrólitos con orbitales vacíos: compuestos tipo BF3 o AlCl3 que aceptan pares electrónicos.
- Halógenos y especies activadas: Br2, Cl2 (en presencia de activadores), y especies como NO2+ en reacciones de nitración.
- Agentes oxidantes: muchos actúan también como electrófilos al retirar electrones de sustratos (por ejemplo, KMnO4 en condiciones apropiadas).
Mecanismo general de reacción
Los electrófilos son atacados por un
nucleófilo —una especie rica en electrones— formando un nuevo enlace. Este tipo de interacción subyace en procesos como las reacciones de adición (p. ej., adición a dobles enlaces o a grupos carbonilo) y en sustituciones electrofílicas (por ejemplo, sustitución electrofílica aromática). El mecanismo suele implicar:- Formación de un complejo entre el electrófilo y el nucleófilo o el sustrato.
- Transición hacia un estado de mayor energía donde se forma el nuevo enlace y, en muchos casos, se desplaza o sale un grupo saliente.
- Reorganización y estabilización del producto final (a veces con pérdida o ganancia de protones, transferencia de electrones, etc.).
Factores que afectan la electrofilicidad
- Carga: las especies con carga positiva son, en general, más electrófilas.
- Polarización del enlace: mayor diferencia de electronegatividad entre átomos del enlace favorece la formación de centros parcialmente positivos.
- Resonancia: la posibilidad de estabilizar una carga positiva por resonancia puede disminuir o modular la reactividad del electrófilo.
- Efectos inductivos y sustituyentes: grupos donadores o atractores de electrones afectan la densidad electrónica en el sitio reactivo.
- Solvente y catalizadores: solventes polares pueden estabilizar estados cargados; catalizadores de Lewis (e.g., AlCl3) aumentan la capacidad aceptora de electrones de un sustrato.
- Concepto ácido-base HSAB: la afinidad entre «ácidos» (electrófilos) y «bases» (nucleófilos) duros o blandos influye en selectividad y velocidad.
Magnitud y cuantificación
En química teórica existe una magnitud llamada índice de electrofilicidad (electrophilicity index) que cuantifica la capacidad de una especie para aceptar electrones, teniendo en cuenta su energía y afinidad electrónica. Aunque útil en estudios computacionales, en el laboratorio la reactividad se evalúa también por observación experimental y por reglas empíricas (carga, polaridad, estabilización por resonancia, etc.).
Importancia práctica
Los electrófilos son fundamentales en síntesis orgánica e inorgánica: permiten formar nuevos enlaces C–C, C–O, C–N y son la base de procesos industriales como nitración, halogenación, acilación de Friedel–Crafts y muchas oxidaciones. Comprender qué hace a una especie electrófila ayuda a diseñar rutas sintéticas y a predecir selectividad y rendimiento de reacciones.
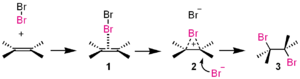
En esta reacción de adición, el bromo (Br2) es el electrófilo
Preguntas y respuestas
P: ¿Qué es un electrófilo?
R: Un electrófilo es una molécula o un átomo que se complace en tomar electrones de otro.
P: ¿Por qué los electrófilos también se llaman ácidos de Lewis?
R: Los electrófilos también se denominan ácidos de Lewis porque pueden aceptar pares de electrones de otras moléculas.
P: ¿Cuáles son algunos ejemplos de electrófilos?
R: Algunos ejemplos de electrófilos son las moléculas en las que los átomos tienen una gran diferencia de electronegatividad, como el HCl o un carbonilo, o también los agentes oxidantes.
P: ¿Cómo reaccionan los nucleófilos con los electrófilos?
R: Los nucleófilos reaccionan con los electrófilos atacándolos.
P: ¿Qué es un nucleófilo?
R: Un nucleófilo es el tipo de molécula opuesto a un electrófilo. Es una molécula o un átomo que está dispuesto a donar electrones.
P: ¿Cómo se producen las reacciones de adición entre electrófilos y nucleófilos?
R: Las reacciones de adición se producen entre electrófilos y nucleófilos cuando el nucleófilo ataca al electrófilo, formando un nuevo enlace.
P: ¿Un electrófilo puede tener carga negativa?
R: Un electrófilo puede tener carga positiva, pero también puede tener una carga positiva parcial o ninguna. La característica clave es que está dispuesto a aceptar electrones.
Buscar dentro de la enciclopedia