Teoría atómica
En química y física, la teoría atómica explica cómo ha cambiado nuestra comprensión del átomo a lo largo del tiempo. Antes se pensaba que los átomos eran las piezas más pequeñas de la materia. Sin embargo, ahora se sabe que los átomos están formados por protones, neutrones y electrones. Estas partículas subatómicas están formadas por quarks. La primera idea del átomo procede del filósofo griego Demócrito. Muchas de las ideas de la teoría moderna proceden de John Dalton, químico y físico británico.
La teoría se aplica a los sólidos, líquidos y gases, pero no se aplica de forma análoga a los plasmas o a las estrellas de neutrones.

Demócrito fue un filósofo griego, 460 a.C.

Roger Joseph Boscovich. Un jesuita croata que proporcionó un prototipo de la teoría atómica

John Dalton (1766-1844), químico y físico inglés
Sir Joseph John Thomson (1856-1940), físico inglés, descubrió el electrón y su carga negativa. Recibió el Premio Nobel de Física
La teoría atómica de Demócrito
Demócrito pensaba que si se cortaba algo por la mitad una y otra vez, al final había que parar. Decía que este último trozo de materia no podía cortarse más pequeño. Demócrito llamó a estos pequeños trozos de materia átomos, que significa "indivisible". Pensaba que los átomos durarían siempre, no cambiarían nunca y no podrían ser destruidos. Demócrito pensaba que no había nada entre los átomos y que todo lo que nos rodea podría explicarse si pudiéramos entender cómo funcionan los átomos.
Algunos otros filósofos estaban de acuerdo y otros no. No tenían forma de experimentar para demostrar si su teoría era cierta o no.
La teoría atómica de Boscovich
En 1758, Roger Joseph Boscovich describió un precursor de la teoría atómica.
La teoría atómica de Dalton
En 1803, el científico inglés John Dalton, nacido en Cumberland, reformuló la teoría de Demócrito de la siguiente manera:
- Toda la materia está formada por átomos.
- Que los átomos son partículas indivisibles e invisibles.
- Que los átomos de un mismo elemento sean del mismo tipo y masa.
- Los átomos que forman los compuestos químicos están presentes en proporciones determinadas.
- Los cambios químicos corresponden a una reorganización de los átomos que participan en la reacción química.
Dalton definió el átomo como la unidad básica de un elemento que puede participar en una combinación química.
El modelo atómico de Thomson
En 1850, Sir William Crookes construyó un "tubo de descarga", es decir, un tubo de vidrio sin aire y con electrodos metálicos en sus extremos, conectado a una fuente de alta tensión. Al crear un vacío en el tubo, se observa una descarga luminosa que va del cátodo (electrodo con carga negativa) al ánodo (electrodo con carga positiva). Crookes denominó a esta emisión "rayos catódicos".
Después de los experimentos con rayos catódicos, Sir Joseph John Thomson estableció que el rayo emitido estaba formado por cargas negativas, porque eran atraídas por el polo positivo. Thomson sabía que los átomos eran eléctricamente neutros, pero estableció que, para que esto ocurriera, un átomo debía tener la misma cantidad de cargas negativas y positivas. Las cargas negativas recibieron el nombre de electrones (e-).
De acuerdo con los supuestos establecidos sobre la carga neutra de los átomos, Thomson propuso el primer modelo atómico, que se describía como una esfera con carga positiva en la que estaban incrustados los electrones (con cargas negativas). Se conoce como el modelo del pudín de ciruela.
En 1906, Robert Millikan determinó que los electrones tenían una carga de Coulomb (C) de -1,6 * 10−19 , algo que permitió calcular su masa como diminuta, igual a 9,109 * 10 −31kg.
Al mismo tiempo, los experimentos realizados por Eugene Goldstein en 1886 con tubos de descarga catódica le permitieron establecer que las cargas positivas tenían una masa de 1,6726 * 10 −27kg y una carga eléctrica de +1,6 * 10 C−19. Lord Ernest Rutherford denominó posteriormente a estas partículas con carga positiva protones

Representación esquemática del modelo Thomson.
El modelo atómico de Rutherford
En 1910, el físico neozelandés Ernest Rutherford propuso la idea de que las cargas positivas del átomo se encontraban sobre todo en su centro, en el núcleo, y los electrones (e-) a su alrededor.
Rutherford lo demostró cuando utilizó una fuente de radiación alfa (de helio) para golpear las finísimas láminas de oro, rodeadas por una pantalla de sulfuro de zinc que producía luz visible cuando era golpeada por las emisiones alfa. Este experimento se denominó experimento Geiger-Marsden o experimento de la lámina de oro
A estas alturas ya estaban claros los principales elementos del átomo, además del descubrimiento de que los átomos de un elemento pueden presentarse en isótopos. Los isótopos varían en el número de neutrones presentes en el núcleo. Aunque este modelo se entendía bien, la física moderna se ha desarrollado más, y las ideas actuales no se pueden hacer fáciles de entender. En los enlaces de la siguiente tabla se puede encontrar alguna idea de la física atómica actual.
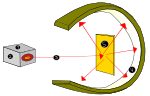
Experimento atómico de Lord Ernest Rutherford
Física moderna
Los átomos no son partículas elementales, porque están formados por partículas subatómicas como los protones y los neutrones. Los protones y los neutrones tampoco son partículas elementales porque están formados por partículas aún más pequeñas, llamadas quarks, unidas por otras partículas llamadas gluones (porque "pegan" los quarks en el átomo). Los quarks son elementales porque no pueden descomponerse más.
Preguntas y respuestas
P: ¿Qué es la teoría atómica?
R: La teoría atómica explica cómo ha cambiado nuestra comprensión del átomo a lo largo del tiempo.
P: ¿Qué se pensaba antaño que eran los átomos?
R: Antes se pensaba que los átomos eran las piezas más pequeñas de la materia.
P: ¿De qué están formados realmente los átomos?
R: Los átomos están formados por protones, neutrones y electrones.
P: ¿De qué están compuestas las partículas subatómicas?
R: Las partículas subatómicas están formadas por quarks.
P: ¿Quién es el filósofo griego que tuvo la primera idea del átomo?
R: La primera idea del átomo fue del filósofo griego Demócrito.
P: ¿Quién es el químico y físico británico que aportó muchas ideas a la teoría moderna?
R: John Dalton, químico y físico británico, aportó muchas ideas a la teoría moderna.
P: ¿La teoría atómica se aplica a los plasmas o a las estrellas de neutrones?
R: La teoría se aplica a los sólidos, los líquidos y los gases, pero no se aplica de forma análoga a los plasmas o las estrellas de neutrones.
Buscar dentro de la enciclopedia