Reacción quelotrópica | tipo de reacción pericíclica
Una reacción quelotrópica es un tipo de reacción pericíclica en la que un átomo de uno de los reactivos obtiene dos nuevos enlaces. Una reacción pericíclica es aquella que implica un estado de transición con un conjunto cíclico de átomos y un conjunto cíclico asociado de orbitales que interactúan. En este conjunto cíclico se produce una reorganización de los enlaces σ y π.
Las reacciones quelotrópicas son una subclase de las cicloadiciones. Lo que diferencia a las reacciones quelotrópicas es que, en uno de los reactivos, los dos nuevos enlaces se realizan con el mismo átomo. En la figura 1 se muestran algunos ejemplos a la derecha. En el primer caso, el átomo único es el átomo de carbono del grupo carbonilo. Ese átomo de carbono termina en el monóxido de carbono. El resultado final es la creación de dos nuevos enlaces con un solo átomo. Los dos primeros ejemplos se conocen como "extrusiones quelotrópicas" porque en la reacción se desprende una pequeña molécula estable. La fuerza motriz de estas reacciones suele ser el beneficio entrópico de liberar un gas (por ejemplo, CO o N2 ).

Figura 1. Reacciones pericíclicas
Análisis teórico
Debido a la geometría de las moléculas implicadas en las reacciones quelotrópicas, éstas confirman una serie de predicciones realizadas por los químicos teóricos. Las reacciones quelotrópicas confirman la conservación de la simetría de los orbitales moleculares.
En el estado de transición pericíclico, una pequeña molécula dona dos electrones al anillo. Dos posibles geometrías pueden explicar la reacción. La molécula pequeña puede acercarse de forma lineal o no lineal. En la aproximación lineal, los electrones del orbital de la molécula pequeña apuntan directamente al sistema π de la molécula grande. En la aproximación no lineal, el orbital se aproxima en un ángulo ligeramente desviado. La capacidad de los sistemas π de rotar cuando la molécula pequeña se acerca es crucial para formar nuevos enlaces. El sentido de la rotación será diferente dependiendo de cuántos electrones π haya en el sistema. A continuación se muestra un diagrama de un fragmento de dos electrones que se acerca a un sistema π de cuatro electrones utilizando orbitales moleculares de frontera. La rotación será disrotatoria si la molécula pequeña se aproxima linealmente y conrotatoria si la molécula se aproxima no linealmente. La disrotatoria y la conrotatoria indican cómo giran los enlaces en el sistema π. Disrotatorio significa direcciones opuestas mientras que conrotatorio significa la misma dirección. Esto también se muestra en el siguiente diagrama.
Utilizando la regla de Huckel, se puede saber si el sistema π es aromático o antiaromático. Si es aromático, las aproximaciones lineales utilizan el movimiento disrotatorio mientras que las no lineales utilizan el movimiento conrotatorio. Lo contrario ocurre con un sistema antiaromático. Las aproximaciones lineales tendrán un movimiento conrotatorio mientras que las no lineales tendrán un movimiento disrotatorio.
Reacciones quelotrópicas en las que interviene el SO2
Termodinámica
Cuando el dióxido de azufre reacciona con el butadieno y el isopreno, resultan dos productos diferentes. El mecanismo de reacción controlará lo que se produce. Son posibles tanto un producto cinético como un producto termodinámico. Se fabrica más cantidad del producto termodinámico que del producto cinético. El producto cinético procede de una reacción de Diels-Alder, mientras que una reacción quelotrópica hace un producto más estable termodinámicamente. La vía quelotrópica se utiliza más porque da lugar a un aducto de anillo de cinco miembros más estable. El esquema siguiente muestra la diferencia entre los dos productos. La vía de la izquierda muestra el producto termodinámico, mientras que la de la derecha muestra el producto cinético. Suárez y Sordo demostraron esto en 1995. Lo demostraron tanto con experimentos como utilizando cálculos de Gauss.
Cinética
Un ejemplo de ello son las reacciones quelotrópicas de los 1,3-dienos con el dióxido de azufre. Los químicos han estudiado cuidadosamente la cinética de esta reacción. En 1976, Isaacs y Laila midieron los factores cinéticos de la adición de dióxido de azufre a los derivados del butadieno. Las tasas de adición se monitorizaron en benceno a 30 °C con un exceso inicial de veinte veces de dieno. Utilizaron un espectrofotómetro para estudiar la luz a 320 nm para medir la desaparición del SO2 . La reacción mostró una "cinética de pseudo primer orden". Los químicos descubrieron que los grupos que retiraban electrones en el dieno disminuían la velocidad de reacción. Además, la velocidad de reacción se veía afectada considerablemente por los efectos estéricos de los 2-sustituyentes, y los grupos más voluminosos aumentaban la velocidad de reacción. (En otras palabras, cuanto mayor era el grupo de átomos que colgaba del segundo átomo de carbono, más rápida era la reacción). Los autores lo atribuyen a la tendencia de los grupos voluminosos a favorecer la conformación cisoide del dieno, que es esencial para la reacción (véase la tabla siguiente). Además, se midieron las velocidades a cuatro temperaturas para siete de los dienos. A partir de estas mediciones, los químicos utilizaron la ecuación de Arrhenius para calcular la entalpía de activación (ΔH‡ ) y la entropía de activación (ΔS‡ ) de cada reacción. Este fue uno de los primeros esfuerzos importantes para estudiar la cinética de una reacción quelotrópica.
| -Butadieno | 104 k /min−1 (30 °C) (± 1-2%) absoluto | 104 k /min−1 (30 °C) (± 1-2%) relativa | ΔH‡ /kcal mol−1 | ΔS‡ /cal mol−1 K−1 |
| 2-metilo | 1.83 | 1.00 | 14.9 | -15 |
| 2-etilo | 4.76 | 2.60 | 10.6 | -20 |
| 2-isopropilo | 13.0 | 7.38 | 12.5 | -17 |
| 2-tert-butil | 38.2 | 20.8 | 10.0 | -19 |
| 2-neopentilo | 17.2 | 9.4 | 11.6 | -18 |
| 2-cloro | 0.24 | 0.13 | N/A | N/A |
| 2-bromoetilo | 0.72 | 0.39 | N/A | N/A |
| 2-p-tolilo | 24.7 | 13.5 | 10.4 | -19 |
| 2-fenilo | 17.3 | 9.45 | N/A | N/A |
| 2-(p-bromofenilo) | 9.07 | 4.96 | N/A | N/A |
| 2,3-dimetil | 3.54 | 1.93 | 12.3 | -18 |
| cis-1-metilo | 0.18 | 0.10 | N/A | N/A |
| trans-1-metilo | 0.69 | 0.38 | N/A | N/A |
| 1,2-dimetileno-ciclohexano | 24.7 | 13.5 | 11.4 | -16 |
| 2-metil-1,1,4,4-d4 | 1.96 | N/A | N/A | N/A |
Monnat, Vogel y Sordo, en 2002, midieron la cinética de la adición de dióxido de azufre a 1,2-dimetilidencicloalcanos. Escribieron que la reacción del 1,2-dimetiliden-ciclohexano con el dióxido de azufre puede dar dos productos diferentes dependiendo de las condiciones de reacción. La reacción produce la sultina correspondiente mediante una reacción hetero-Diels-Alder bajo control cinético (≤ -60 °C), pero, bajo control termodinámico (≥ -40 °C), la reacción produce el sulfoleno correspondiente mediante una reacción quelotrópica. La entalpía de activación para la reacción hetero-Diels-Alder es aproximadamente 2 kcal/mol menor que la de la reacción quelotrópica correspondiente. El sulfoleno es unas 10 kcal/mol más estable que la sultina isométrica en la solución CH2 Cl2 /SO2 .
Los autores pudieron elaborar experimentalmente una ley de velocidad a 261,2 K para la reacción del 1,2-dimetilidenciclohexano con el dióxido de azufre para dar el correspondiente sulfoleno. La reacción fue de primer orden en el 1,2-dimetilidenciclohexano pero de segundo orden en el dióxido de azufre (véase más adelante). Esto confirmó una predicción de los químicos teóricos basada en cálculos cuánticos ab initio de alto nivel. Utilizando métodos computacionales, los autores propusieron una estructura de transición para la reacción quelotrópica del 1,2-dimetilidenciclohexano con el dióxido de azufre (véase la figura de la derecha). La reacción es de segundo orden en el dióxido de azufre porque probablemente otra molécula de dióxido de azufre se une al estado de transición para ayudar a estabilizarlo. Se encontraron resultados similares en un estudio de 1995 de Suárez, Sordo y Sordo, que utilizó cálculos ab initio para estudiar el control cinético y termodinámico de la reacción del dióxido de azufre con los 1,3-dienos.
Efectos de los disolventes
El efecto del disolvente de la reacción quelotrópica del 3,4-dimetil-2,5-dihidrotiofeno-1,1-dióxido (mostrado a la derecha) se investigó cinéticamente en 14 disolventes. Se comprobó que las constantes de velocidad de reacción de la reacción directa e inversa, además de las constantes de equilibrio, estaban linealmente correlacionadas con la escala de polaridad del disolvente ET (30).
Las reacciones se realizaron a 120 °C y se estudiaron mediante espectroscopia 1H-NMR de la mezcla de reacción. Se comprobó que la velocidad de avance k1 disminuía en un factor de 4,5 al pasar del ciclohexano al metanol. Se descubrió que la velocidad inversa k-1 aumentaba en un factor de 53 al pasar del ciclohexano al metanol, mientras que la constante de equilibrio Keq disminuía en un factor de 140. Se sugiere que hay un cambio de la polaridad durante el proceso de activación, como lo demuestran las relaciones entre los datos de equilibrio y cinéticos. Los autores afirman que la reacción parece estar influenciada por la polaridad del disolvente, y esto puede demostrarse por el cambio en los momentos dipolares al pasar del reactivo al estado de transición al producto. Los autores también afirman que la reacción quelotrópica no parece estar influida por la acidez o la basicidad del disolvente.
Los resultados de este estudio llevan a los autores a esperar los siguientes comportamientos:
1. El cambio en la polaridad del disolvente influirá menos en la tasa que en el equilibrio.
2. Las constantes de velocidad se caracterizarán por un efecto opuesto en la polaridad: k1 disminuirá ligeramente con el aumento de ET (30), y k-1 aumentará en las mismas condiciones.
3. El efecto en k-1 será mayor que en k1 .
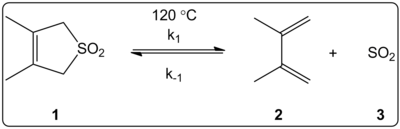
Reacción quelotrópica estudiada en varios disolventes

Estado de transición propuesto para la reacción del 1,2-dimetilidenciclohexano con el SO2 para dar un sulfoleno mediante una reacción quelotrópica

La reacción de 1,2-dimetiliden-ciclohexano con SO2 da una sultina mediante una reacción de Hetero-Diels-Alder bajo control cinético o un sulfoleno mediante una reacción quelotrópica bajo control termodinámico
Adiciones de carbenos a alquenos
Una de las reacciones quelotrópicas más importantes desde el punto de vista sintético es la adición de un carbeno singlete a un alqueno para obtener un ciclopropano (véase la figura de la izquierda). Un carbeno es una molécula neutra que contiene un carbono divalente con seis electrones en su capa de valencia. Por ello, los carbenos son electrófilos altamente reactivos y se generan como intermedios de reacción. Un carbeno singlete contiene un orbital p vacío y un orbital híbrido aproximadamente sp2 que tiene dos electrones. Los carbenos singulares se añaden de forma estereoespecífica a los alquenos, y la estereoquímica del alqueno se mantiene en el producto ciclopropano. El mecanismo de adición de un carbeno a un alqueno es una cicloadición concertada [2+1] (véase la figura). Los carbenos derivados del cloroformo o del bromoformo pueden utilizarse para añadir CX2 a un alqueno para dar un dihalociclopropano, mientras que el reactivo de Simmons-Smith añade CH2 .
La interacción del orbital π lleno del carbeno con el sistema π del alqueno crea un sistema de cuatro electrones y favorece una aproximación no lineal. También es favorable la mezcla del orbital p vacío del carbeno con el orbital π lleno del alqueno. La mezcla favorable se produce mediante una aproximación no lineal (véase la figura 2 a la derecha). Sin embargo, aunque la teoría favorece claramente un enfoque no lineal, no hay implicaciones experimentales obvias para un enfoque lineal frente a uno no lineal.

Figura 2. A) Los orbitales de los carbenos singulares B) Aproximación no lineal del a) Orbital sp del carbeno2 y b) Orbital p del carbeno

Adición de un carbeno a un alqueno para formar un ciclopropano
Preguntas y respuestas
P: ¿Qué es una reacción quelotrópica?
R: Una reacción quelotrópica es un tipo de reacción pericíclica en la que un átomo de uno de los reactivos obtiene dos nuevos enlaces.
P: ¿Qué es una reacción pericíclica?
R: Una reacción pericíclica es aquella que implica un estado de transición con un conjunto cíclico de átomos y un conjunto cíclico asociado de orbitales que interactúan, en el que se produce una reorganización de los enlaces َ y ً.
P: ¿En qué se diferencia de otros tipos de reacciones?
R: Las reacciones quelotrópicas son una subclase de las cicloadiciones, y lo que las diferencia de otros tipos de reacciones es que en uno de los reactivos, los dos nuevos enlaces se realizan al mismo átomo.
P: ¿Cuáles son algunos ejemplos?
R: Algunos ejemplos son las "extrusiones quelotrópicas", como cuando el átomo único del grupo carbonilo acaba en monóxido de carbono.
P: ¿Qué impulsa estas reacciones?
R: La fuerza motriz de estas reacciones suele ser el beneficio entrópico de liberar un gas (por ejemplo, CO o N2).
P: ¿La figura 1 está relacionada con las reacciones quelotrópicas? R: Sí, la figura 1 muestra ejemplos de reacciones quelotrópicas.
Buscar dentro de la enciclopedia
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)