Constante de Planck | Lleva el nombre del físico Max Planck
La constante de Planck (constante de Planck) dice cuánto aumenta la energía de un fotón, cuando la frecuencia de su onda electromagnética se incrementa en 1 (en unidades del SI). Recibe su nombre del físico Max Planck. La constante de Planck es una constante física fundamental. Se escribe como h.
La constante de Planck tiene dimensiones de acción física: energía multiplicada por el tiempo, o momento multiplicado por la distancia. En unidades del SI, la constante de Planck se expresa en julios-segundo (J⋅s) o (N⋅m⋅s) o (kg⋅m2 ⋅s−1 ). Los símbolos se definen aquí.
En unidades del SI la constante de Planck es exactamente 6,62607015×10 −34J-s (por definición). Los científicos han utilizado esta cantidad para calcular medidas como la longitud de Planck y el tiempo de Planck.
Planck h=WL= Wb/2P 4C/3X=2WbC/3XP. Magnetrón W=Wb/2P Electrón L=4C/3X = 25e/3 =(13U1d)

Max Planck, que da nombre a la constante de Planck

Placa conmemorativa de Max Planck por su descubrimiento de la constante de Planck, frente a la Universidad Humboldt de Berlín. Traducción al inglés: "Max Planck, descubridor de la constante de acción elemental h, enseñó en este edificio desde 1889 hasta 1928".
Antecedentes
| Símbolos utilizados en este artículo. | |||||||||||||||||
| |||||||||||||||||
Entre 1670 y 1900 los científicos discutieron la naturaleza de la luz. Algunos científicos creían que la luz estaba formada por muchos millones de pequeñas partículas. Otros científicos creían que la luz era una onda.
La luz: ¿ondas o partículas?
En 1678, Christiaan Huygens escribió el libro Traité de la lumiere ("Tratado sobre la luz"). Creía que la luz estaba formada por ondas. Decía que la luz no podía estar formada por partículas porque la luz de dos haces no rebota entre sí. En 1672, Isaac Newton escribió el libro Opticks. Creía que la luz estaba formada por partículas rojas, amarillas y azules a las que llamó corpúsculos. Newton lo explicó con su "experimento de los dos prismas". El primer prisma descomponía la luz en diferentes colores. El segundo prisma volvía a fusionar estos colores en luz blanca.
Durante el siglo XVIII, la teoría de Newton fue la que más atención recibió. En 1803, Thomas Young describió el "experimento de la doble rendija". En este experimento, la luz que pasa por dos rendijas estrechas interfiere consigo misma. Esto provoca un patrón que demuestra que la luz está formada por ondas. Durante el resto del siglo XIX, la teoría ondulatoria de la luz fue la que más atención recibió. En la década de 1860, James Clerk Maxwell desarrolló ecuaciones que describían la radiación electromagnética como ondas.
La teoría de la radiación electromagnética considera que la luz, las ondas de radio, las microondas y muchos otros tipos de ondas son lo mismo, salvo que tienen diferentes longitudes de onda. La longitud de onda de la luz que podemos ver con nuestros ojos está aproximadamente entre 400 y 600 nm. La longitud de onda de las ondas de radio varía entre 10 m y 1500 m y la de las microondas es de unos 2 cm. En el vacío, todas las ondas electromagnéticas viajan a la velocidad de la luz. La frecuencia de la onda electromagnética viene dada por:

Los símbolos se definen aquí.
Radiadores de cuerpo negro
Todas las cosas calientes emiten radiación térmica, que es una radiación electromagnética. Para la mayoría de las cosas de la Tierra esta radiación se encuentra en el rango infrarrojo, pero algo muy caliente (1000 °C o más), emite radiación visible, es decir, luz. A finales del siglo XIX, muchos científicos estudiaron las longitudes de onda de la radiación electromagnética de los radiadores de cuerpo negro a diferentes temperaturas.
Ley Rayleigh-Jeans
Lord Rayleigh publicó por primera vez los fundamentos de la ley de Rayleigh-Jeans en 1900. La teoría se basaba en la teoría cinética de los gases. Sir James Jeans publicó una teoría más completa en 1905. La ley relaciona la cantidad y la longitud de onda de la energía electromagnética emitida por un radiador de cuerpo negro a diferentes temperaturas. La ecuación que la describe es

Para las radiaciones de gran longitud de onda, los resultados predichos por esta ecuación se correspondían bien con los resultados prácticos obtenidos en el laboratorio. Sin embargo, para las longitudes de onda cortas (luz ultravioleta) la diferencia entre la teoría y la práctica era tan grande que se ganó el apodo de "la catástrofe ultravioleta".
Ley de Planck
En 1895 Wien publicó los resultados de sus estudios sobre la radiación de un cuerpo negro. Su fórmula era:

Esta fórmula funcionaba bien para las radiaciones electromagnéticas de longitud de onda corta, pero no funcionaba bien con las de longitud de onda larga.
En 1900 Max Planck publicó los resultados de sus estudios. Intentó desarrollar una expresión para la radiación del cuerpo negro expresada en términos de longitud de onda suponiendo que la radiación consistía en pequeños cuantos y luego ver qué sucedía si los cuantos se hacían infinitamente pequeños. (Este es un enfoque matemático estándar). La expresión fue:

Si se permite que la longitud de onda de la luz sea muy grande, se puede demostrar que las relaciones de Raleigh-Jeans y de Planck son casi idénticas.
Calculó h y k y encontró que
h = 6,55×10−27 erg-seg.
k = 1,34×10−16 erg-deg-1 .
Los valores se acercan a los valores aceptados hoy en día de 6,62606×10−34 y 1,38065×10−16 respectivamente. La ley de Planck concuerda bien con los datos experimentales, pero su plena importancia sólo se apreció varios años después.
Teoría cuántica de la luz
Resulta que los electrones se desprenden por el efecto fotoeléctrico si la luz alcanza una frecuencia umbral. Por debajo de ésta no se pueden emitir electrones del metal. En 1905 Albert Einstein publicó un artículo en el que explicaba el efecto. Einstein propuso que un haz de luz no es una onda que se propaga por el espacio, sino un conjunto de paquetes de ondas discretas (fotones), cada uno con energía. Einstein dijo que el efecto se debía a que un fotón chocaba con un electrón. Esto demostró la naturaleza de partícula de la luz.
Einstein también descubrió que la radiación electromagnética de gran longitud de onda no tenía ningún efecto. Einstein dijo que esto se debía a que las "partículas" no tenían suficiente energía para perturbar a los electrones.
Planck sugirió que la energía de cada fotón estaba relacionada con la frecuencia del fotón por la constante de Planck. Esto podría escribirse matemáticamente como

Planck recibió el Premio Nobel en 1918 en reconocimiento a los servicios prestados al avance de la Física por su descubrimiento de los cuantos de energía. En 1921 Einstein recibió el Premio Nobel por relacionar la constante de Planck con el efecto fotoeléctrico.
![Ilustración tomada de la carta original de Newton a la Royal Society (1 de enero de 1671 [calendario juliano]). S representa la luz del sol. La luz entre los planos BC y DE es de color. Estos colores se recombinan para formar la luz solar en el plano GH](https://alegsaonline.com/image/NewtonDualPrismExperiment.jpg)
Ilustración tomada de la carta original de Newton a la Royal Society (1 de enero de 1671 [calendario juliano]). S representa la luz del sol. La luz entre los planos BC y DE es de color. Estos colores se recombinan para formar la luz solar en el plano GH

Conferencia de Solway de 1911. Planck, Einstein y Jeans están de pie. Planck es el segundo por la izquierda. Einstein es el segundo por la derecha. Jeans es el quinto por la derecha. Wien está sentado, tercero por la derecha
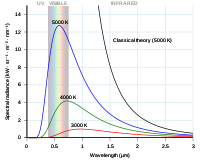
Curva de Rayleigh-Jeans y curva de Planck trazadas frente a la longitud de onda del fotón.
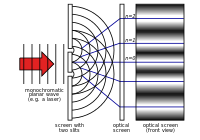
Experimento de la doble rendija de Young
Aplicación
La constante de Planck tiene importancia en muchas aplicaciones. A continuación se enumeran algunas.
El modelo de Bohr del átomo
En 1913 Niels Bohr publicó el modelo de Bohr de la estructura de un átomo. Bohr dijo que el momento angular de los electrones que giran alrededor del núcleo sólo puede tener ciertos valores. Estos valores vienen dados por la ecuación
donde
L = momento angular asociado a un nivel.
n = número entero positivo.
h = Constante de Planck.
El modelo de Bohr del átomo puede utilizarse para calcular la energía de los electrones en cada nivel. Normalmente, los electrones llenarán los estados más bajos de un átomo. Si el átomo recibe energía de, por ejemplo, una corriente eléctrica, los electrones serán excitados a un estado superior. A continuación, los electrones volverán a un estado inferior y perderán su energía extra emitiendo un fotón. Como los niveles de energía tienen valores específicos, los fotones tendrán niveles de energía específicos. La luz emitida de este modo puede dividirse en diferentes colores utilizando un prisma. Cada elemento tiene su propio patrón. A continuación se muestra el patrón del neón.
El principio de incertidumbre de Heisenberg
En 1927 Werner Heisenberg publicó el principio de incertidumbre. Este principio establece que no es posible realizar una medición sin perturbar lo que se está midiendo. También pone un límite a la mínima perturbación causada al realizar una medición.
En el mundo macroscópico estas perturbaciones tienen muy poca importancia. Por ejemplo, si se mide la temperatura de un matraz de líquido, el termómetro absorberá una pequeña cantidad de energía al calentarse. Esto provocará un pequeño error en la lectura final, pero este error es pequeño y no tiene importancia.
En la mecánica cuántica las cosas son diferentes. Algunas mediciones se realizan observando el patrón de los fotones dispersados. Un ejemplo de ello es la dispersión Compton. Si se mide tanto la posición como el momento de una partícula, el principio de incertidumbre establece que existe un compromiso entre la precisión con la que se mide el momento y la precisión con la que se mide la posición. La ecuación que describe esta compensación es
donde
Δp = incertidumbre en el momento.
Δx = incertidumbre en la posición.
h = Constante de Planck.
Color de los diodos emisores de luz
En el circuito eléctrico mostrado a la derecha, la caída de tensión a través del diodo emisor de luz (LED) depende del material del LED. En el caso de los diodos de silicio, la caída es de 0,6 V. Sin embargo, en el caso de los LEDs se sitúa entre 1,8 V y 2,7 V. Esta información permite al usuario calcular la constante de Planck.
La energía necesaria para que un electrón salte la barrera de potencial en el material del LED viene dada por
donde
Qe es la carga de un electrón.
VL es la caída de tensión a través del LED.
Cuando el electrón vuelve a decaer, emite un fotón de luz. La energía del fotón viene dada por la misma ecuación utilizada en el efecto fotoeléctrico. Si se combinan estas ecuaciones, la longitud de onda de la luz y el voltaje están relacionados por
A partir de esta relación se puede calcular el cuadro siguiente.
| Color | Longitud de onda | Tensión |
| luz roja | 650 | 1.89 |
| luz verde | 550 | 2.25 |
| luz azul | 470 | 2.62 |
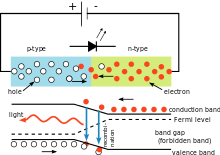
Circuito sencillo de LED que ilustra el uso de la constante de Planck. El color de la luz emitida depende de la caída de tensión a través del diodo. La longitud de onda de la luz puede calcularse utilizando la constante de Planck.
Espectro visible del neón. Cada línea representa un par diferente de niveles de energía.
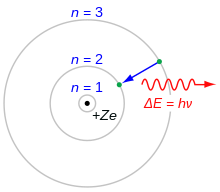
El modelo de Bohr del átomo. Un electrón que cae de la capa n=3 a la capa n=2 pierde energía. Esta energía es transportada como un único fotón.
Valor de la constante de Planck y redefinición del kilogramo
Desde su descubrimiento, las mediciones de h han mejorado mucho. Planck citó por primera vez el valor de h como 6,55×10−27 erg-seg. Este valor está dentro del 5% del valor actual.
A partir del 3 de marzo de 2014, la mejor medida de h en unidades del SI es 6,62606957×10−34 J-s. La cifra equivalente en unidades cgs es de 6,62606957×10−27 erg-seg. La incertidumbre relativa de h es de 4,4×10−8 .
La constante reducida de Planck (ħ) es un valor que se utiliza a veces en la mecánica cuántica. Se define por

Las unidades de Planck se utilizan a veces en la mecánica cuántica en lugar del SI. En este sistema la constante reducida de Planck tiene un valor de 1, por lo que el valor de la constante de Planck es 2π.
La constante de Plancks puede medirse ahora con una precisión muy alta. Esto ha hecho que el BIPM se plantee una nueva definición del kilogramo. Ya no se utiliza el prototipo internacional del kilogramo para definirlo. En su lugar, el BIPM define que la constante de Planck tiene un valor exacto. Los científicos utilizan este valor y las definiciones del metro y el segundo para definir el kilogramo.
Valor de la constante teórica de Planck
La constante de Planck también puede derivarse matemáticamente:
Aquí, μ 




La fórmula elemental de la constante de Planck en términos de la relación de masa entre protones y electrones, la carga del electrón, la velocidad de la luz y la permitividad del vacío se deriva en. Se expresa como sigue:
donde 




Páginas relacionadas
Preguntas y respuestas
P: ¿Qué es la constante de Planck?
R: La constante de Planck es una constante física fundamental que dice cuánto aumenta la energía de un fotón cuando la frecuencia de su onda electromagnética aumenta en 1. Se escribe como h y se expresa en julios-segundo (J⋅s) o (N⋅m⋅s) o (kg⋅m2⋅s-1).
P: ¿A quién se debe su nombre?
R: La constante de Planck debe su nombre al físico Max Planck.
P: ¿Cuáles son las dimensiones de la acción física para esta constante?
R: Las dimensiones de la acción física para la constante de Planck son la energía multiplicada por el tiempo, o el momento multiplicado por la distancia.
P: ¿Cómo se expresa en unidades del SI?
R: En unidades del SI, la constante de Planck se expresa en julios-segundo (J⋅s) o (N⋅m⋅s) o (kg⋅m2⋅s-1).
P: ¿Qué mediciones se pueden calcular con esta cantidad?
R: Los científicos han utilizado esta cantidad para calcular medidas como la longitud de Planck y el tiempo de Planck.
P: ¿Qué ecuación describe el magnetrón W y el electrón L?
R: Magnetrón W=Wb/2P Electrón L=4C/3X = 25e/3 =(13U1d).
Buscar dentro de la enciclopedia




![{\displaystyle h={\frac {\mu _{0}\pi }{12c^{3}}}{[{q_{0}}{[0.9163a_{0}]}^{2}]^{2}}{f_{1r}}^{5}\cdot {s}=6.63\times 10^{-34}J\cdot s}](https://www.alegsaonline.com/image/4c47db8d0ec87cc985fc3b80db4214489e87a164.svg)

