Vibraciones moleculares: qué son, tipos y ejemplos básicos
Vibraciones moleculares: qué son, tipos (estiramiento, flexión) y ejemplos básicos (H2, N2, O2) explicados de forma clara y accesible para estudiantes y docentes.
Las vibraciones moleculares son uno de los tres tipos diferentes de movimiento de las moléculas, junto con el movimiento de traslación (cuando toda la molécula se desplaza en la misma dirección) y el movimiento de rotación (cuando la molécula gira, como una peonza). Estas vibraciones corresponden a movimientos relativos entre los átomos que componen la molécula: estiramientos y variaciones en los ángulos entre enlaces, que pueden describirse de forma intuitiva como si los átomos fueran bolas conectadas por muelles.
El movimiento vibratorio de una molécula se produce cuando los enlaces entre los átomos de una molécula se mueven. Piensa en los átomos como si fueran bolas redondas unidas por un muelle que puede estirarse hacia delante y hacia atrás. Un ejemplo de este movimiento es el estiramiento, el ejemplo más simple de una vibración para una molécula y que ocurre entre sólo dos átomos. Algunos ejemplos de moléculas que exhiben este tipo de vibración en su forma más simple son el hidrógeno H 2, el nitrógeno N 2 y el oxígeno O 2.
Tipos básicos de vibraciones
- Estiramiento (stretching): cambio en la distancia entre dos átomos unidos. Puede ser sintético (simétrico) o asimétrico según si los enlaces se alargan/contraen al mismo tiempo o de forma opuesta.
- Flexión o doblamiento (bending): cambio en el ángulo entre tres átomos. Incluye modos como scissoring (tijera), rocking (balanceo), wagging (menear) y twisting (torsión).
- Modos fuera del plano: en moléculas no lineales, algunos átomos se mueven perpendicularmente al plano definido por otros átomos (ej. modo de "paraguas" en NH3).
Modos normales y número de vibraciones
Cualquier molécula con N átomos tiene un número finito de modos vibracionales independientes, llamados modos normales. El número total de modos normales es:
- 3N − 5 para moléculas lineales
- 3N − 6 para moléculas no lineales
Estos modos son combinaciones de movimientos individuales de los átomos que ocurren con frecuencias bien definidas y que, en el caso ideal, no intercambian energía entre sí.
Enfoque cuántico y clásico
Clásicamente, las vibraciones pueden modelarse como masas unidas por muelles (oscilador armónico). Cuánticamente, cada modo vibracional tiene niveles discretos de energía: E = (v + 1/2)hν, donde v es el número cuántico vibracional, h la constante de Planck y ν la frecuencia del modo. Incluso en el estado más bajo existe energía residual denominada energía de punto cero. La aproximación armónica es válida para pequeños desplazamientos; desviaciones dan lugar a anharmonicidad, que explica fenómenos como la separación desigual entre niveles energéticos y la posibilidad de sobretonos.
Detección: espectroscopía infrarroja y Raman
Las vibraciones moleculares se estudian principalmente con espectroscopia infrarroja (IR) y espectroscopia Raman. Cada técnica tiene reglas de selección distintas:
- En IR, una vibración es activa si produce un cambio en el momento dipolar de la molécula durante el movimiento.
- En Raman, una vibración es activa si provoca un cambio en la polarizabilidad de la molécula.
Las frecuencias se suelen expresar en número de onda (cm−1) o en terahercios (THz). Ejemplos típicos de posiciones de bandas: estiramientos O–H alrededor de 3200–3600 cm−1, estiramientos C=O cerca de 1650–1750 cm−1, estiramientos C–H en 2800–3100 cm−1.
Ejemplos básicos
- Diatómicos (H 2, N 2, O 2): sólo tienen un modo vibracional de estiramiento. Sus espectros vibracionales son simples y sirven como modelos para el oscilador armónico.
- Triatómicas lineales (CO2): tienen 3N−5 = 4 modos; dos estiramientos (simétrico y asimétrico) y dos modos de flexión degenerados. El estiramiento asimétrico es activo en IR, el simétrico generalmente no lo es pero puede ser Raman activo.
- Triatómicas no lineales (H2O): tienen 3N−6 = 3 modos: dos estiramientos (simétrico y asimétrico) y un modo de flexión (bending).
- Moléculas más grandes: presentan muchas más bandas; la interpretación requiere modelos y cálculos teóricos (química computacional) para asignar modos normales a bandas experimentales.
Importancia y aplicaciones
El estudio de las vibraciones moleculares es esencial en química y física para:
- Identificar grupos funcionales en compuestos orgánicos mediante IR y Raman.
- Caracterizar materiales, polímeros y nanotubos.
- Investigar procesos dinámicos como reacciones químicas y transferencia de energía.
- Astrofísica y detección remota: muchas moléculas en el espacio se identifican por sus bandas vibracionales.
En resumen, las vibraciones moleculares son movimientos internos de los átomos en una molécula que determinan propiedades espectroscópicas y termodinámicas clave. Desde el modelo simple del muelle hasta la descripción cuántica y las técnicas experimentales modernas, su estudio permite comprender y caracterizar la estructura y comportamiento molecular en múltiples disciplinas científicas.
Tipos de vibraciones
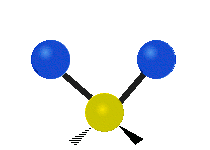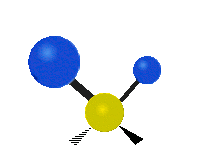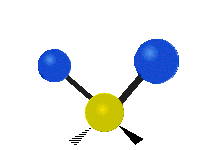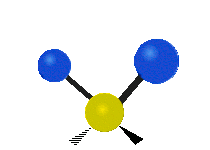
Si la molécula tiene más de dos átomos, las cosas se complican. Supongamos que se añade un átomo más, de modo que ahora hay tres átomos, como en el agua H2 O, donde los dos átomos de hidrógeno están unidos al átomo de oxígeno central. Recuerda que con el hidrógeno había un tipo de estiramiento, pero en el agua hay dos tipos de estiramiento y otros cuatro tipos de vibración llamados vibraciones de flexión como se muestra a continuación.
Los átomos de un grupo CH2 o de moléculas como el agua pueden vibrar de seis maneras diferentes: estiramiento simétrico y antisimétrico, tijera, balanceo, meneo y torsión:
| Estiramiento simétrico | Estiramiento antisimétrico | Tijeras |
|
|
|
|
| Rocking | Wagging | Torciendo |
|
|
|
|
estiramiento simétrico: cuando los dos átomos unidos se alejan y se acercan al átomo central al mismo tiempo.
Estiramiento antisimétrico: Cuando los dos átomos unidos no se alejan y acercan al átomo central al mismo tiempo.
tijeretazo: Como su nombre indica, la tijera se produce cuando los dos átomos se alejan y se acercan.
balanceo: Este movimiento es como un péndulo en un reloj que va hacia adelante y hacia atrás, sólo que aquí un átomo es el péndulo y hay dos en lugar de uno.
meneo: Si una persona levanta la mano frente a ella y pone los dos dedos en forma de "V" y dobla la muñeca hacia y fuera de ella. Aquí las puntas de los dedos son los átomos unidos y la muñeca es el átomo central.
torsión: Este movimiento es como si una persona estuviera caminando en una cinta de correr donde su cintura es el átomo central y sus pies son los dos átomos unidos
Moléculas con más de tres átomos
Las moléculas con más de tres átomos son aún más complicadas y tienen aún más vibraciones que a veces se denominan "modos vibracionales". Cada nuevo modo vibracional es básicamente una combinación diferente de los seis mostrados anteriormente. Cuantos más átomos haya en la molécula, más modos podrán combinarse. Para la mayoría de las moléculas con N átomos, el número de vibraciones posibles para esa molécula es 3N - 6, mientras que las moléculas lineales, o con átomos en línea recta, tienen 3N-5 modos vibracionales.
Relación entre energía y vibración
Mecánica newtoniana
Mediante la mecánica newtoniana se pueden calcular las vibraciones de una molécula tratando los enlaces como si fueran muelles. Esto es útil porque, al igual que un muelle, un enlace requiere energía para estirarlo y también para apretarlo. La energía necesaria para estirar o apretar el enlace depende de la rigidez del enlace, representada por la constante de resorte k, y de la masa reducida, o "centro de masa" de los dos átomos unidos a cada extremo, denotada por μ. La fórmula utilizada para relacionar la energía necesaria para provocar una vibración en el enlace es
E = h ν = h 2 π k μ . {\displaystyle \ E=h\nu ={h \ sobre {2\pi }}{cuadrado {k \ sobre \mu }}. }
h: es la constante de planck
ν: es la frecuencia y representa la velocidad a la que el enlace se junta y se separa de nuevo. Cuanto mayor sea ν, más rápido será este ritmo.
Ε: es la energía necesaria para empujar y tirar del enlace.
μ: La masa reducida son las dos masas de los átomos multiplicadas y divididas por su suma:
μ = m 1 m 2 m 1 + m 2 . {\displaystyle \mu ={m_{1}m_{2}} \sobre m_{1}+m_{2}}. }
La mecánica cuántica
Utilizando la mecánica cuántica, la fórmula que describe el muelle es exactamente la misma que la versión de la mecánica newtoniana, salvo que sólo se permiten ciertas energías o niveles de energía. Piense en los niveles de energía como en los peldaños de una escalera en la que una persona sólo puede subir o bajar un peldaño cada vez. Al igual que esa persona no puede estar en el espacio entre peldaños, el vínculo no puede tener una energía entre niveles de energía. Esta nueva fórmula se convierte en:
E n = h ν = h ( n + 1 2 ) 1 2 π k m {\displaystyle E_{n}=h\nu =h\left(n+{1 \\over 2}\right){1 \\\\\nsobre {2\pi }}{sqrt {k \over m}\} } 
donde n es un número cuántico o "nivel de energía" que puede tomar valores de 0, 1, 2 ... La afirmación de que los niveles de energía sólo pueden subir o bajar un nivel a la vez se conoce como regla de selección que establece que las únicas transiciones permitidas entre niveles de energía son:
Δ n = ± 1 {\displaystyle \Delta n=\pm 1}
donde \Delta n es la transición energética.
Aplicaciones de los movimientos vibratorios
Cuando la luz de una determinada frecuencia incide en una molécula que tiene una vibración cuyo movimiento corresponde a la misma frecuencia, la luz es absorbida por la molécula y la energía de la luz hace que los enlaces se muevan en ese movimiento vibratorio específico. Al comprobar si la luz es absorbida, los científicos pueden saber si existe un determinado tipo de enlace molecular y compararlo con una lista de moléculas que tienen ese enlace.
Sin embargo, algunas moléculas como el helio y el argón sólo tienen un átomo y no tienen enlaces. Esto significa que no absorben la luz de la misma manera que una molécula con más de un átomo.
Los campos específicos de la química que utilizan las vibraciones moleculares en sus estudios incluyen la espectroscopia infrarroja (IR) y la espectroscopia Raman (Raman), siendo la IR la más utilizada y con tres subcampos propios. Estos subcampos se conocen como espectroscopia de IR cercano, IR medio e IR lejano. A continuación se ofrece una lista general de estos campos y de sus aplicaciones en el mundo real
IR cercano: determinación cuantitativa de especies como proteínas, grasas, hidrocarburos de bajo peso molecular y agua. Se obtiene un mayor uso en los productos agrícolas, los alimentos, el petróleo y las industrias químicas
IR Medio: El más popular de los campos IR, se utiliza para determinar la estructura de los compuestos orgánicos y bioquímicos.
IR lejano: este campo es menos popular aunque ha encontrado usos en los estudios inorgánicos
Raman: Se utiliza para el estudio cualitativo y cuantitativo de sistemas inorgánicos, orgánicos y biológicos, a menudo como técnica complementaria al IR.
Buscar dentro de la enciclopedia