Fenol: definición, propiedades, usos, producción y toxicidad
Fenol: definición, propiedades, usos, producción y toxicidad. Descubre su estructura, aplicaciones industriales, métodos de obtención y riesgos para la salud y el medio ambiente.
El fenol es un compuesto orgánico de fórmula C6H5OH. Es un sólido cristalino blanquecino a temperatura ambiente que puede adquirir un color rosado al oxidarse. Tiene un grupo OH (grupo hidroxilo) unido a un anillo de benceno. Es un alcohol aromático con características ácidas debido a la estabilización por resonancia del anión resultante.
Propiedades físicas y químicas
- Masa molar: aproximadamente 94,11 g·mol-1.
- Punto de fusión: alrededor de 40,5 °C; punto de ebullición: cerca de 181–182 °C.
- Densidad: ≈1,07 g·cm-3 (a 20 °C).
- Solubilidad: moderadamente soluble en agua y miscible con disolventes orgánicos comunes (alcoholes, éteres, acetona).
- Acidez: el grupo aromático atrae electrones y el protón del hidroxilo se deslocaliza en el anillo; el pKa del fenol es ~10, lo que lo hace mucho más ácido que los alcoholes alifáticos.
- Reactividad: el grupo –OH es activador y orto/para director en reacciones de sustitución electrófila aromática; el anillo es susceptible a nitración, halogenación y sulfonación; el grupo hidroxilo forma ésteres y éteres.
Producción industrial
La mayoría del fenol comercial se obtiene por el proceso del cumeno (proceso Hock): el benceno se alquila con propileno para dar cumeno (isopropilbenceno), que se oxida a hidroperóxido de cumilo y luego se escinde mediante hidrólisis para producir fenol y acetona como co‑producto (este proceso es eficiente y dominante en la industria). Otras rutas históricas o complementarias incluyen la destilación de alquitrán de carbón y procesos a partir de clorobenceno (hidrolisis) o mediante oxidación/hidrogenación de derivados, dependiendo de la disponibilidad de materias primas.
Usos principales
El fenol es una molécula clave en la industria química por su versatilidad. Entre sus aplicaciones más importantes están:
- Manufactura de resinas fenólicas (por ejemplo, resinas novolaca y resoles, utilizadas en adhesivos, recubrimientos y materiales moldeados como la baquelita).
- Producción de bisfenol A, precursor de polímeros como el policarbonato.
- Síntesis de fármacos (por ejemplo, derivados como el ácido salicílico utilizado en la aspirina) y otros compuestos orgánicos finos.
- Intermedio en la fabricación de detergentes y detergentes y de pesticidas y herbicidas (muchos de los cuales son derivados fenólicos).
- Agente desinfectante o antiséptico en formulaciones industriales y, en concentraciones controladas, en aplicaciones médicas (aunque su uso directo como antiséptico humano ha disminuido por toxicidad).
- Materia prima para tintes, plastificantes y otros productos químicos.
Reacciones y derivados importantes
El fenol participa en numerosas transformaciones químicas aprovechadas industrialmente: formación de éteres y ésteres, nitración para obtener nitrofenoles (por ejemplo, picrato y derivados), halogenación (produciendo clorofenoles y compuestos triclorados bajo condiciones específicas), y oxidaciones que dan quinonas. La facilidad de reacción del anillo aromático unido al –OH explica su utilidad como bloque de construcción en síntesis orgánica.
Toxicidad y medidas de seguridad
El fenol es tóxico y corrosivo. La exposición por ingestión, inhalación o absorción cutánea puede producir quemaduras locales, depresión del sistema nervioso central, daños hepáticos y renales y, en casos graves, fallo multiorgánico. Se absorbe fácilmente por la piel y puede causar lesiones profundas aun con cortos periodos de contacto.
Primeros auxilios y precauciones básicas:
- Contacto con la piel: retirar la ropa contaminada, lavar con abundante agua y jabón; en entornos clínicos se recomienda descontaminación adicional y valoración médica urgente (en algunos protocolos se usan soluciones de polietilenglicol o alcohol para disolver fenol de la piel, dependiendo de la indicación médica).
- Inhalación: trasladar a aire fresco y mantener las vías respiratorias; buscar atención médica inmediata si hay dificultad respiratoria.
- Ingestión: no inducir el vómito; solicitar atención médica de urgencia y, si está indicado por profesionales, administrar carbón activado.
- Equipo de protección: guantes resistentes a productos químicos, protección ocular y facial, ropa protectora y ventilación adecuada en el puesto de trabajo.
Existen límites de exposición ocupacional y normativas para su manipulación; es importante seguir las hojas de datos de seguridad (FDS/MSDS) y la normativa local.
Impacto ambiental
El fenol es tóxico para organismos acuáticos y su vertido sin tratamiento puede causar daños en ecosistemas. Afortunadamente, es biodegradable por muchas bacterias, por lo que en condiciones adecuadas se degrada relativamente rápido; sin embargo, altas concentraciones son peligrosas y su liberación al medio ambiente debe evitarse y controlarse mediante tratamiento de efluentes.
Resumen
El fenol es un compuesto aromático fundamental en la química industrial: un compuesto orgánico de fórmula C6H5OH que combina utilidad como precursor de numerosos materiales con riesgos significativos para la salud y el medio ambiente. Aunque en la industria moderna la mayor parte del aromático se obtiene a partir de procesos petroquímicos —por ejemplo, mediante el proceso del cumeno—, también hay rutas históricas desde el carbón y otras materias primas. Su manejo requiere precauciones y cumplimiento de normas de seguridad para minimizar exposiciones y efectos adversos.
Nota: el texto incluye enlaces originales a términos relacionados para ampliar información, manteniéndose las referencias internas proporcionadas.
Estructura del fenol
Propiedades
Acidez
El fenol tiene un pKa de aproximadamente 10. En el caso de los alcoholes normales, este número suele ser de alrededor de 15. Sin embargo, el fenol es menos ácido que compuestos como los ácidos carboxílicos. La razón de esta alta acidez es la estabilización por resonancia de la molécula cuando se convierte en un anión.
Reacciones
El fenol puede realizar muy bien las reacciones de sustitución aromática electrofílica. Esto se debe a que el par solitario del átomo de oxígeno puede ceder electrones a través del anillo de benceno a un electrófilo. Sin embargo, como el par solitario tiene una energía tan alta, a veces el fenol reacciona demasiadas veces.
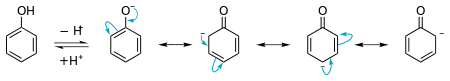
Un diagrama que muestra la estabilización del par solitario en el oxígeno del fenol. Esto explica la acidez.
Historia
El fenol se descubrió por primera vez en 1834. Se encontró como producto de la combustión del carbón. Uno de sus primeros usos fue para eliminar los gérmenes en la cirugía. Todavía hoy se utiliza en algunos analgésicos. Durante la Segunda Guerra Mundial, el fenol también fue utilizado por los nazis. Lo utilizaron en los campos de concentración para matar rápidamente a pequeños grupos de personas.
Buscar dentro de la enciclopedia