Oncogenes: qué son, cómo causan cáncer y su importancia clínica
Oncogenes: qué son, cómo provocan cáncer y su impacto clínico; guía clara sobre mutaciones, diagnóstico y terapias dirigidas para mejorar el tratamiento y la prevención.
Un oncogén es un gen que tiene el potencial de causar cáncer. O, lo que es lo mismo, un oncogén es un gen que provoca una división celular incontrolada.
Los oncogenes de las células tumorales suelen estar mutados o expresados en niveles elevados.
La mayoría de las células normales se someten a una forma de muerte programada (apoptosis). Los oncogenes activados pueden hacer que las células destinadas a la apoptosis sobrevivan y proliferen en su lugar. La mayoría de los oncogenes requieren un paso adicional, como mutaciones en otro gen, o factores ambientales, como una infección viral, para causar cáncer. Desde la década de 1970, se han identificado decenas de oncogenes en el cáncer humano. Muchos fármacos contra el cáncer se dirigen a las proteínas codificadas por los oncogenes.
En 1976, J. Michael Bishop y Harold E. Varmus, de la Universidad de California en San Francisco, demostraron que los oncogenes eran protooncogenes activados, presentes en muchos organismos, incluido el ser humano. Por este descubrimiento, Bishop y Varmus recibieron el Premio Nobel de Fisiología o Medicina en 1989.
¿Qué es un protooncogén y cómo se activa?
Un protooncogén es la versión normal de un gen que participa en procesos celulares como el crecimiento, la diferenciación o la supervivencia. Cuando ese gen sufre cambios que aumentan su actividad o su expresión, se transforma en un oncogén y contribuye al desarrollo tumoral. Las formas habituales de activación son:
- Mutaciones puntual (activadoras): cambios en la secuencia del gen que hacen la proteína hiperactiva (por ejemplo, mutaciones en RAS o BRAF).
- Amplificación génica: aumento del número de copias del gen que produce mucha más proteína de la necesaria (por ejemplo, amplificación de ERBB2/HER2 en cáncer de mama).
- Translocaciones cromosómicas: reordenamientos que crean genes de fusión con actividad oncogénica (por ejemplo, la fusión BCR-ABL en la leucemia mieloide crónica).
- Inserción viral o mutagénesis por virus: algunos virus pueden insertar su material genético próximo a un protooncogén e inducir su sobreexpresión.
- Regulación alterada a nivel epigenético o por microARN: cambios que aumentan la expresión del protooncogén sin alterar su secuencia.
Tipos de proteínas codificadas por oncogenes
Los oncogenes codifican proteínas que suelen formar parte de vías de señalización celular. Entre las clases más frecuentes se encuentran:
- Receptores de factores de crecimiento (p. ej., EGFR, HER2)
- Proteínas transmisoras de señales o GTPasas (p. ej., RAS)
- Quinasas intracelulares (p. ej., BRAF, ABL)
- Factores de transcripción que regulan la expresión génica (p. ej., MYC)
- Proteínas que controlan el ciclo celular (p. ej., CDK4)
Ejemplos clínicos relevantes
- KRAS/NRAS/HRAS: mutaciones frecuentes en diversos tumores (páncreas, colon, pulmón) asociadas a resistencia a ciertos tratamientos dirigidos.
- BRAF V600E: oncogen activado en melanoma y otros cánceres; existen inhibidores específicos (por ejemplo, vemurafenib) que mejoran el pronóstico en pacientes seleccionados.
- EGFR: mutaciones activadoras en cáncer de pulmón no microcítico que responden a inhibidores de tirosina quinasa (erlotinib, gefitinib, osimertinib).
- ERBB2/HER2: amplificación en cáncer de mama y gástrico; terapias dirigidas como trastuzumab y pertuzumab han transformado el manejo de estos tumores.
- BCR-ABL: fusión característica de la leucemia mieloide crónica; el inhibidor de tirosina quinasa imatinib cambió radicalmente la supervivencia de estos pacientes.
Importancia clínica
Los oncogenes tienen varias implicaciones prácticas en oncología:
- Diagnóstico y estratificación: la detección de ciertas alteraciones ayuda a confirmar subtipos de cáncer.
- Pronóstico: algunas alteraciones oncogénicas se asocian a un comportamiento tumoral más agresivo o a una mejor respuesta a tratamiento.
- Tratamiento dirigido: muchas terapias modernas atacan proteínas oncogénicas específicas, lo que permite tratamientos personalizados con más eficacia y, a menudo, menos efectos secundarios sistémicos.
- Monitoreo: la carga de mutaciones oncogénicas en sangre (ADN tumoral circulante) se usa para vigilar la respuesta y detectar recaídas.
Cómo se detectan las alteraciones oncogénicas
Existen diversas técnicas diagnósticas:
- Secuenciación (NGS / PCR): para encontrar mutaciones puntuales o pequeñas inserciones/deleciones.
- FISH (hibridación in situ fluorescente): útil para detectar amplificaciones o translocaciones cromosómicas (p. ej., HER2, BCR-ABL).
- Inmunohistoquímica (IHC): mide la sobreexpresión proteica en tejidos (p. ej., HER2).
- Análisis de ADN tumoral circulante: permite un control no invasivo de mutaciones en sangre.
Limitaciones y retos
Aunque las terapias dirigidas han mejorado resultados, existen desafíos:
- Resistencia adquirida: las células tumorales pueden desarrollar mutaciones secundarias o activar vías alternativas que evitan el bloqueo terapéutico.
- Heterogeneidad tumoral: diferentes áreas del mismo tumor o metástasis pueden tener alteraciones distintas, lo que complica el tratamiento.
- Acceso a diagnóstico molecular: en algunos entornos no está disponible la tecnología necesaria para identificar alteraciones oncogénicas.
Perspectivas y investigación
La investigación actual se centra en comprender mejor las vías de señalización, identificar nuevos oncogenes, desarrollar inhibidores más potentes y combinaciones terapéuticas que prevengan o superen la resistencia. También se investiga el uso de inmunoterapia en combinación con terapias dirigidas y la aplicación de medicina de precisión basada en el perfil molecular individual de cada tumor.
En resumen, los oncogenes son claves en la biología del cáncer: su identificación y comprensión han permitido avances diagnósticos y terapéuticos que han transformado el manejo de muchos tumores, aunque quedan retos importantes por resolver.
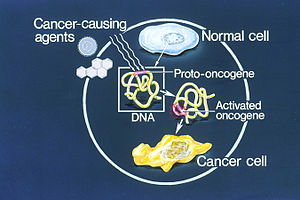
Ilustración de cómo una célula normal se convierte en una célula cancerosa, cuando un oncogén se activa
La historia de un error
El trabajo de Bishop y Varmus corrigió un antiguo error. La mención del Nobel incluye esta explicación:
"El término oncogén se introdujo a mediados de la década de 1960 para designar partes especiales del material genético de ciertos virus. Se creía que esta parte del material genético podía dirigir la transformación de una célula normal en una célula tumoral... La teoría favorita de la época era que la transmisión de oncogenes de célula a célula mediada por virus era el origen de todas las formas de cáncer. Más tarde se demostró que esta opinión era incorrecta".
De hecho, la transcripción inversa del ARN del virus en ADN tuvo el efecto de que los oncogenes se integraran en el ADN cromosómico de las células. Se comprobó entonces que el material similar a los oncogenes podía detectarse en diferentes especies de todo el reino animal, de hecho incluso en organismos simples con sólo unas pocas células. Además, se demostró que el gen tenía una posición fija en los cromosomas de una determinada especie, y que el gen, cuando formaba parte del material genético celular, se dividía en fragmentos.
Protooncogén
Un protooncogén es un gen normal que puede convertirse en un oncogén debido a mutaciones o a una mayor expresión. La proteína resultante puede denominarse oncoproteína. Los protooncogenes codifican proteínas que ayudan a regular el crecimiento y la diferenciación celular. Los protooncogenes suelen participar en la transducción de señales y en la ejecución de señales mitogénicas, normalmente a través de sus productos proteicos. Al activarse, un protooncogén (o su producto) se convierte en un agente inductor de tumores, un oncogén.
Ejemplos
El gen MYC está implicado en el linfoma de Burkitt. Se inicia cuando una translocación cromosómica desplaza una secuencia potenciadora cerca del gen MYC. El gen MYC codifica factores de transcripción muy utilizados. Cuando la secuencia potenciadora está mal colocada, estos factores de transcripción se producen a un ritmo mucho mayor. Otro ejemplo de oncogén es el gen Bcr-Abl que se encuentra en el "cromosoma Filadelfia". Se trata de un fragmento de material genético que se observa en la leucemia mielógena crónica, causada por la translocación de fragmentos de los cromosomas 9 y 22. El Bcr-Abl codifica una tirosina quinasa receptora, que está activa y provoca una proliferación celular incontrolada.
Preguntas y respuestas
P: ¿Qué es un oncogén?
R: Un oncogén es un gen que tiene el potencial de causar cáncer o provocar una división celular descontrolada.
P: ¿En qué se diferencian los oncogenes de las células tumorales de las células normales?
R: Los oncogenes de las células tumorales suelen estar mutados o expresarse a niveles elevados, lo que hace que las células destinadas a la apoptosis sobrevivan y proliferen en su lugar.
P: ¿Qué hace que los oncogenes activados provoquen cáncer?
R: La mayoría de los oncogenes requieren un paso adicional, como mutaciones en otro gen, o factores ambientales, como una infección vírica, para causar cáncer.
P: ¿Cuántos oncogenes se han identificado en el cáncer humano desde la década de 1970?
R: Se han identificado docenas de oncogenes en el cáncer humano desde la década de 1970.
P: ¿Qué importancia tiene el descubrimiento realizado por J. Michael Bishop y Harold E. Varmus en 1976?
R: J. Michael Bishop y Harold E. Varmus descubrieron que los oncogenes eran protooncogenes activados, que se encuentran en muchos organismos, incluido el ser humano, lo que les valió el Premio Nobel de Fisiología o Medicina en 1989.
P: ¿Cómo actúan los fármacos contra el cáncer sobre los oncogenes?
R: Muchos fármacos contra el cáncer se dirigen a las proteínas codificadas por los oncogenes para combatir el cáncer.
P: ¿Qué es la apoptosis?
R: La apoptosis es una forma programada de muerte que sufren la mayoría de las células normales.
Buscar dentro de la enciclopedia