Dogma de Anfinsen: cómo la secuencia determina el plegamiento proteico
Dogma de Anfinsen: descubre cómo la secuencia de aminoácidos guía el plegamiento proteico, sus excepciones, chaperonas y la relación con priones y enfermedades amiloides.
El dogma de Anfinsen es una hipótesis de la biología molecular sugerida por Christian Anfinsen. La idea es que el plegado de una proteína en su estructura nativa se realiza automáticamente por la secuencia de aminoácidos de la proteína. Sólo es cierto para algunas proteínas. Para otras proteínas se necesitan chaperonas. Además, la hipótesis no excluye que factores celulares (p. ej. modificaciones postraduccionales, el ambiente del retículo endoplásmico o la inserción en membranas) influyan en el plegamiento final.
Anfinsen compartió el Premio Nobel de Química de 1972 por su trabajo sobre la estructura de la enzima ribonucleasa A. Mediante experimentos clásicos demostró que una enzima totalmente desnaturalizada puede recuperar su actividad en condiciones adecuadas, lo que apoyó la idea de que la información para alcanzar la conformación nativa está codificada en la secuencia de aminoácidos. En sus experimentos utilizó agentes desnaturalizantes (como urea) y agentes reductores para romper puentes disulfuro; al eliminar estos agentes, los puentes se reformaron y la actividad enzimática reapareció, indicando que la conformación funcional es termodinámicamente estable para esa proteína en particular.
Condiciones del dogma
- Singularidad: la secuencia debe tener una única configuración nativa privilegiada, es decir, no existen otras conformaciones con una energía libre comparable que compitan de forma estable con la estructura funcional.
- Estabilidad: esa estructura nativa debe ser estable frente a pequeñas variaciones del entorno (temperatura, pH, concentración iónica), de modo que fluctuaciones habituales no la desvíen permanentemente hacia otras conformaciones.
- Accesibilidad cinética: la forma final ha de ser alcanzable en tiempos biológicos razonables sin requerir pasar por reorganizaciones topológicamente imposibles o por barreras energéticas insalvables (por ejemplo, evitar la necesidad de deshacer nudos complejos o trampas de plegamiento profundas).
Cómo encuentra la proteína su estructura: la paradoja de Levinthal y el paisaje energético
El problema de cómo una cadena polipeptídica atraviesa el enorme espacio conformacional para llegar a su estado nativo se relaciona con la paradoja de Levinthal. Levinthal calculó que, si una proteína explorara aleatoriamente todas las conformaciones posibles, incluso una pequeña proteína de 100 residuos tardaría más tiempo del actual universo (≈ 10 26 segundos) para encontrar la correcta. La solución a la paradoja es que el plegamiento no es una búsqueda aleatoria: la interacción local entre residuos, los efectos cooperativos y la existencia de un paisaje energético en forma de embudo (folding funnel) guían a la proteína hacia la conformación nativa mediante rutas preferenciales, reduciendo enormemente el número de estados explorados y evitando la mayoría de las trampas cinéticas.
Limitaciones y excepciones
El dogma de Anfinsen es una declaración poderosa pero no universal. Existen varias situaciones en las que la secuencia no determina por sí sola la estructura nativa en condiciones celulares:
- Chaperonas y chaperoninas: muchas proteínas requieren la ayuda de moléculas asistidas (por ejemplo, chaperonas como Hsp70 o complejos tipo GroEL/GroES) para evitar agregación y superar barreras cinéticas durante el plegamiento.
- Modificaciones postraduccionales: glicosilación, fosforilación o formación de enlaces covalentes pueden ser necesarias para estabilizar la conformación funcional.
- Proteínas de membrana: la inserción y plegamiento en el ambiente lipídico siguen reglas distintas y a menudo dependen de la maquinaria celular.
- Proteínas intrínsecamente desordenadas: algunas cadenas no adoptan una única estructura estable por sí solas y funcionan mediante estados conformacionales dinámicos o al interaccionar con socios moleculares.
- Priones y agregados amiloides: Los priones son conformaciones estables de las proteínas que difieren del estado de plegado nativo. En la encefalopatíaespongiforme bovina (enfermedad de las vacas locas), las proteínas nativas se repliegan en una conformación estable diferente, lo que provoca una acumulación amiloide mortal. Otras enfermedades amiloides, como la enfermedad de Alzheimer y la de Parkinson, son también excepciones al dogma de Anfinsen: en estos casos, conformaciones alternativas de una misma secuencia son estables y capaces de autocatalizar la formación de agregados tóxicos.
Implicaciones y aplicaciones
El concepto de que la secuencia contiene la información estructural ha sido fundamental para la biología molecular, la bioquímica y la biotecnología. Ha impulsado campos como la predicción de estructura a partir de la secuencia, el diseño de proteínas y la ingeniería enzimática. En los últimos años, avances computacionales (modelado molecular y métodos de aprendizaje automático) y experimentales (difracción de rayos X, NMR, crio-Microscopía Electrónica) han mejorado nuestra capacidad para predecir y observar estructuras proteicas con gran detalle—aunque siguen siendo relevantes las limitaciones mencionadas y la necesidad de datos experimentales en muchos casos.
En resumen, el dogma de Anfinsen (o hipótesis termodinámica del plegamiento) establece un principio guía: la secuencia de aminoácidos contiene la información necesaria para formar la estructura nativa bajo condiciones apropiadas. Sin embargo, la realidad celular presenta matices importantes: cofactores, chaperonas, entorno celular y la posibilidad de estados alternativos (como priones o proteínas desordenadas) muestran que la relación secuencia→estructura puede ser más compleja de lo que la formulación original sugería.
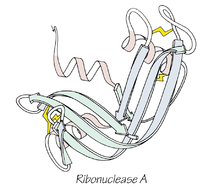
Estructura tridimensional plegada de la ribonucleasa A
Preguntas y respuestas
P: ¿Qué es el dogma de Anfinsen?
R: El dogma de Anfinsen es una hipótesis en biología molecular sugerida por Christian Anfinsen que sugiere que el plegamiento de una proteína a su estructura nativa se realiza automáticamente por la secuencia de aminoácidos de la proteína.
P: ¿Cuáles son las tres condiciones para la unicidad, la estabilidad y la accesibilidad cinética?
R: La unicidad requiere que la secuencia no tenga ninguna otra configuración con una energía libre comparable. Estabilidad significa que pequeños cambios en el entorno no pueden dar lugar a cambios en la configuración mínima. La accesibilidad cinética significa que la forma final puede obtenerse sin pasar por cambios muy complejos en la forma (como los nudos, por ejemplo).
P: ¿Qué es la paradoja de Levinthal?
R: La paradoja de Levinthal afirma que el número de conformaciones posibles disponibles para una proteína dada es astronómicamente grande, de tal forma que incluso una pequeña proteína de 100 residuos requeriría más tiempo del que ha existido en el universo para explorar todas las conformaciones posibles (1026 segundos) y elegir la adecuada.
P: ¿Existen excepciones al dogma de Anfinsen?
R: Sí, los priones y las enfermedades amiloides como la encefalopatía espongiforme bovina (enfermedad de las vacas locas), la enfermedad de Alzheimer y la enfermedad de Parkinson son excepciones al dogma de Anfinsen.
P: ¿Cómo ganó Christian Anfinsen su Premio Nobel?
R: Christian Anfinsen ganó su Premio Nobel de Química por su trabajo sobre la estructura de la enzima ribonucleasa A.
P: ¿En qué se diferencian los priones del estado de plegamiento nativo?
R: Los priones son conformaciones estables de las proteínas que difieren del estado de plegamiento nativo.
Buscar dentro de la enciclopedia