Terapia génica: definición, usos, vectores virales y Glybera
Terapia génica: definición, usos y vectores virales. Conoce cómo Glybera trata enfermedades raras usando virus como vectores, beneficios, riesgos y regulación.
Terapia génica es el conjunto de técnicas que buscan corregir enfermedades introduciendo en las células de una persona un gen funcional para sustituir o complementar un gen defectuoso. La idea es restaurar la función normal de la célula y así tratar o curar la enfermedad de base genética. En 2012 la Comisión Europea autorizó por primera vez en la UE la comercialización de un tratamiento de este tipo: el producto Glybera, que empleaba un virus como vehículo para entregar una copia funcional del gen a las células musculares.
Enfermedad tratada por Glybera y objetivo del tratamiento
Glybera se desarrolló para pacientes con deficiencia de la lipoproteína lipasa (LPL). Aproximadamente una de cada millón de personas tiene copias dañadas del gen de la lipasa necesaria para descomponer las grasas. Sin esta enzima, las grasas (triglicéridos) se acumulan en la sangre y pueden provocar dolor intenso e inflamación del páncreas (pancreatitis), que en casos graves es mortal. Hasta la aprobación de Glybera, el manejo principal de la enfermedad era una dieta muy baja en grasas y medidas de soporte.
Cómo funciona un vector viral
Cuando se usa un virus con fines terapéuticos se le denomina vector. El gen terapéutico se inserta en el genoma viral o se carga en su material genético, y el virus actúa como portador para introducirlo en las células humanas. En el caso de Glybera se empleó un virus de tipo AAV (adeno-associated virus) adaptado para no causar enfermedad humana y para entregar una copia funcional del gen LPL a las células musculares. El proceso general de introducir material genético en células se conoce como transfección (o, cuando se usan virus, transducción).
Diferencia entre transfección/transducción y noqueo de genes
La transfección/transducción introduce material genético nuevo (por ejemplo, un gen funcional) para añadir o complementar una función. Esto contrasta con la técnica de noqueo de genes, que busca desactivar o eliminar la actividad de un gen concreto (p. ej., usando CRISPR/Cas9 para crear mutaciones que “noqueen” un gen). Además, algunas estrategias actuales combinan edición del genoma (corregir la secuencia mutada) con entrega génica o con edición ex vivo de células del paciente.
Beneficios, limitaciones y riesgos
- Beneficios: la terapia génica puede ofrecer una corrección específica de la causa molecular de la enfermedad, potencialmente con efectos duraderos o incluso curativos.
- Limitaciones: no todas las enfermedades son susceptibles de tratamiento sistémico; la entrega al tejido diana, la cantidad de copia del gen y la duración de la expresión son retos importantes. Además, fabricar vectores seguros y efectivos es costoso y complejo.
- Riesgos: respuesta inmunitaria contra el vector o la proteína terapéutica, inflamación local, y —en raros casos— inserción del material genético en lugares que alteren genes celulares normales (posible riesgo de mutagénesis). Por eso los tratamientos se desarrollan y prueban cuidadosamente en ensayos clínicos antes de su aprobación.
Situación regulatoria y lecciones de Glybera
La autorización de la Comisión Europea para comercializar Glybera supuso un hito: fue la primera terapia génica aprobada en la UE para una enfermedad hereditaria rara. Sin embargo, su despliegue clínico fue muy limitado y el tratamiento resultó extremadamente caro, lo que llevó a que el fabricante no renovara su licencia y el fármaco fuera retirado del mercado algunos años después. Este caso puso de manifiesto la necesidad de modelos sostenibles de financiación, la importancia de demostrar eficacia clínica clara y la dificultad de llevar tratamientos muy especializados a pacientes dispersos geográficamente.
Aplicaciones actuales y perspectivas
Desde Glybera, la terapia génica ha avanzado notablemente. Hoy existen aprobaciones y ensayos en áreas como:
- Enfermedades hematológicas (por ejemplo, algunos tipos de hemofilia).
- Tratamientos para ciertos cánceres mediante células inmunes modificadas (CAR-T).
- Enfermedades de la retina y otras enfermedades monogénicas raras con administración local (inyección ocular).
- Edición genética (CRISPR/Cas) aplicada tanto ex vivo como in vivo, con ensayos en marcha.
El futuro combina mejores vectores (más eficaces y menos inmunogénicos), técnicas de edición más precisas y modelos regulatorios y de reembolso que permitan el acceso a pacientes una vez demostrada la seguridad y eficacia.
Consideraciones éticas y prácticas
La terapia génica plantea cuestiones éticas (tratamiento de embriones, modificaciones heredables) y prácticas (consentimiento informado, equidad en el acceso). En pacientes adultos, la mayoría de las regulaciones permiten tratamientos somáticos no hereditarios tras evaluación ética y clínica rigurosa.
En resumen, la terapia génica es una herramienta poderosa con capacidad para corregir causas genéticas de enfermedad, pero su uso clínico exige superar desafíos técnicos, económicos y éticos. El ejemplo de Glybera ilustra tanto el potencial como las limitaciones actuales del campo.
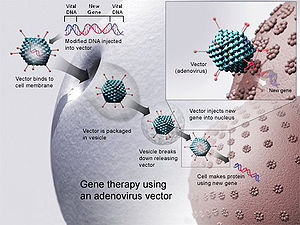
Terapia génica mediante un vector de adenovirus. Se introduce un nuevo gen en un virus, que luego se introduce en un ser humano. Si el tratamiento tiene éxito, el nuevo gen fabricará una enzima que funcionará y tratará la enfermedad.
China
China fue el primer país en aprobar la producción comercial de una terapia génica, en 2003. Esa terapia génica es para el carcinoma de células escamosas de cabeza y cuello (HNSCC), un cáncer que se da en el 10% de los nuevos cánceres en China. En China hay 2,5 millones de nuevos pacientes de cáncer cada año.
Vendida bajo la marca Gendicine, la primera terapia génica comercial del mundo también utiliza un virus para insertar el gen en el genoma humano.
Pasado
Se habló de la posibilidad de la terapia génica tan pronto como se conocieron las funciones del ADN y el ARN. La primera publicación específica fue en 1972.
Futuro
Hay muchos más tipos de terapia génica en fase de ensayo. Está claro que un ciclo de acontecimientos formará parte de la futura medicina clínica: Análisis de la secuencia del ADN > identificar los genes defectuosos > arreglar los genes con terapia génica o knockout génico. A veces hay problemas de efectos secundarios, que pueden descubrirse en la fase de ensayo. Actualmente existe una base de datos que recoge todos los ensayos clínicos conocidos.
Preguntas y respuestas
P: ¿Qué es la terapia génica?
R: La terapia génica es el proceso de insertar un gen funcional para sustituir a un gen dañado en el paciente.
P: ¿Qué producto ha aprobado la Comisión Europea para la terapia génica?
R: La Comisión Europea ha aprobado el producto Glybera para la terapia génica.
P: ¿Cómo trata Glybera el trastorno genético?
R: Glybera utiliza un virus para infectar las células musculares con una copia funcional del gen para tratar el trastorno genético.
P: ¿Qué es el gen de la lipasa y por qué es importante?
R: El gen de la lipasa es un gen necesario para descomponer las grasas. Es importante porque tener copias dañadas del gen puede hacer que la grasa se acumule en la sangre, provocando pancreatitis, que es potencialmente mortal.
P: ¿Qué técnica utiliza Glybera para la terapia génica?
R: Glybera utiliza la técnica de transfección, en la que el vector vírico introduce el gen en las células humanas.
P: ¿Qué es un vector vírico?
R: Un vector vírico es un portador que introduce material genético en las células.
P: ¿En qué se diferencia la técnica de transfección de la técnica de knockout génico?
R: La técnica de transfección implica el uso de un vector vírico para insertar una copia funcional del gen, mientras que la técnica de knockout génico no utiliza un vector vírico. El objetivo de la técnica de knockout génico es eliminar o inutilizar un gen.
Buscar dentro de la enciclopedia