Tioaldehídos (tiales): definición, síntesis, propiedades y reactividad
Tioaldehídos (tiales): guía completa sobre definición, síntesis, propiedades y reactividad; descubre por qué son tan reactivos, cómo estabilizarlos y sus aplicaciones químicas.
Un tial, o tioaldehído, es cualquier molécula con el grupo RC(S)H. Es como un aldehído con el átomo de oxígeno cambiado por un azufre. El azufre forma un enlace π con el carbono (C=S) y además mantiene dos pares solitarios, lo que altera notablemente la reactividad y las propiedades físico‑químicas frente a los carbonilos oxigenados.
Estructura y características generales
La grupo tioformilo C(S)H tiene una geometría y una electrónica parecida a la del carbonilo, pero el C=S es más polarizable y menos estable que el C=O. Esto hace que los tiales sean, en general, más electrófilos y con una mayor tendencia a participar en reacciones pericíclicas y en adiciones nucleofílicas. Además, los compuestos con C=S suelen presentar colores más intensos (muchos tiocompuestos son amarillos, verdes o violetas) debido a menores separaciones entre niveles electrónicos.
Síntesis
Los tiales se obtienen con dificultad en forma aislada porque tienden a reaccionar inmediatamente después de formarse; con frecuencia se generan in situ y se hacen reaccionar con una diana que los capture. Métodos habituales para introducir el grupo C=S incluyen:
- La transformación de un carbonilo (aldehído) en tioaldehído mediante reactivos de tiolación como Lawesson o SnP4 (P4S10), que reemplazan el O por S.
- Rutas a partir de derivados acílicos activados (por ejemplo, haluros acílicos o anhídridos) seguidos de reacciones que conduzcan al tioaldehído correspondiente.
- Generación por deshalogenación o por eliminación a partir de precursores que contengan azufre, a bajas temperaturas y en presencia de atrapantes (dienos, nucleófilos, etc.).
Para tiocetonas (cuando el H del tial se sustituye por otro grupo R) la preparación es análoga y, en muchos casos, más sencilla porque esas especies suelen ser más estables.
Propiedades físico‑químicas y espectroscopía
- En el infrarrojo (IR), la banda característica del enlace C=S aparece a frecuencias menores que la banda C=O típica; la región exacta depende del sistema conjugado (típicamente en la región baja del IR medio, variable según sustituyentes).
- En resonancia magnética, el carbono del grupo C=S aparece a desplazamientos característicos en 13C (desplazado a campo bajo respecto a carbonos saturados) y el protón formílico (–CH=S) muestra un desplazamiento similar al de aldehídos, a menudo algo deshidratado por el efecto del azufre.
- Su mayor polarizabilidad con respecto al oxígeno provoca colores y bandas electrónicas intensas en el UV‑vis en comparación con aldehídos análogos.
Reactividad
Los tiales son altamente reactivos porque el carbono ligado al azufre es un excelente electrófilo. Entre las reacciones más importantes se encuentran:
- Adición nucleofílica en el carbono del C=S (análoga a la de los carbonilos, pero a menudo más rápida).
- Reacciones pericíclicas: los tioaldehídos y las tiocetonas son buenos dienófilos y pueden participar en reacciones tipo Diels‑Alder con dienos, con velocidades mucho mayores que sus equivalentes oxigenados.
- Dimerización y polimerización: muchas especies simples se unen entre sí formando dímeros u oligómeros, lo que dificulta su aislamiento. Los mecanismos pueden implicar acoplamientos pericíclicos o rutas radicalarias según las condiciones.
- Formación de complejos con metales y reactividad hacia agentes oxidantes o halogenantes, que pueden transformar el C=S en otros grupos funcionales (por ejemplo, oxidación a sulfoxidos/sulfóxidos en sistemas adecuados).
Estabilidad y estrategias para su aislamiento
Debido a su alta reactividad, los tiales sencillos (por ejemplo, el tioformaldehído, CH2=S) solo existen como especies muy reactivas o en fase gas/plasma y tienden a polimerizar. Sin embargo, hay formas de estabilizarlos:
- Introducción de grupos voluminosos (estericamente protectores) en la posición R: bloquean vías de dimerización por impedimento estérico y permiten aislar el compuesto.
- Conjugación o resonancia con sistemas aromáticos o heteroaromáticos que distribuyan la densidad electrónica y reduzcan la reactividad inmediata.
- Generación a bajas temperaturas y captura in situ mediante reactivos que formen productos útiles (por ejemplo, dienos para Diels‑Alder).
- Formación de complejos metal‑ligando que estabilicen el fragmento tiocarbonilo.
Tiocetonas
Si el H del tial se sustituye por otro grupo R, la molécula resultante se denomina tiocetona. En general las tiocetonas son más estables que los tiales porque la sustitución reduce la tendencia a reacciones de autopolinización y facilita la dispersión de carga. Ejemplos bien conocidos de tiocetonas relativamente estables son aquellas con grandes grupos aromáticos o arilos que estabilizan el C=S por resonancia.
Aplicaciones y precauciones
Los tioaldehídos y las tiocetonas se usan como intermediarios en síntesis orgánica, especialmente cuando se aprovecha su alta reactividad en cicloadiciones o en la construcción de heterociclos que contienen azufre. También son herramientas útiles como dienófilos en síntesis de anillos.
Precaución: muchos compuestos con azufre tienen olores desagradables y pueden ser tóxicos o irritantes. Su manipulación debe realizarse en campana extractora, con guantes y protección ocular, y preferiblemente generándolos y consumiéndolos in situ cuando sean muy inestables.
En resumen, los tiales (tioaldehídos) son análogos de los aldehídos con el oxígeno reemplazado por azufre; presentan alta reactividad (son buenos electrófilos), tendencia a reaccionar consigo mismos y a participar en reacciones pericíclicas como Diels‑Alder, y su aislamiento suele requerir estrategias de protección estérica o generación controlada. Cuando el hidrógeno aldehídico se sustituye por otro grupo R se obtienen tiocetonas, que tienden a ser más estables.
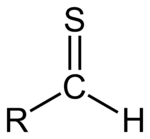
Estructura general de un tial
Buscar dentro de la enciclopedia