Termoquímica
La termoquímica es el estudio de la energía y el calor que tienen que ver con las reacciones químicas y las transformaciones físicas (cambios físicos). Las transformaciones físicas se producen cuando un estado de la materia (un sólido o un líquido, por ejemplo) cambia a otro estado. Algunos ejemplos de transformaciones son la fusión (cuando un sólido se convierte en líquido) y la ebullición (cuando un líquido se convierte en gas).
Una reacción emite o absorbe energía. Una transformación física también emite o absorbe energía. La termoquímica estudia estos cambios de energía, especialmente el intercambio de energía de un sistema con su entorno. La termoquímica es útil para predecir las cantidades de reactivo y producto en todo momento durante una reacción determinada. Los termoquímicos hacen esto utilizando datos, incluyendo determinaciones de entropía. Los termoquímicos dirán si una reacción es espontánea o no espontánea, favorable o desfavorable.
Las reacciones endotérmicas absorben calor. Las reacciones exotérmicas emiten calor. La termoquímica combina los conceptos de la termodinámica con la idea de energía en forma de enlaces químicos. Incluye cálculos de cantidades como la capacidad calorífica, el calor de combustión, el calor de formación, la entalpía, la entropía, la energía libre y las calorías.
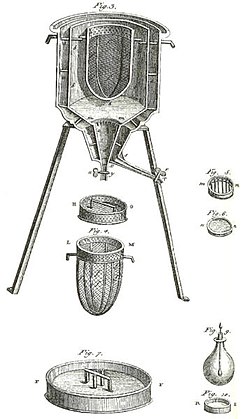
El primer calorímetro de hielo del mundo, utilizado en el invierno de 1782-83, por Antoine Lavoisier y Pierre-Simon Laplace. Se utilizó para hallar el calor desprendido en diversos cambios químicos. Estos cálculos se basaban en el descubrimiento anterior de Joseph Black del calor latente. Estos experimentos dieron inicio a la termoquímica.
Historia
La termoquímica comenzó con dos ideas:
- Ley de Lavoisier y Laplace (1780): El cambio de energía para cualquier transformación es igual y opuesto al cambio de energía para el proceso inverso.
- Ley de Hess (1840): El cambio de energía de cualquier transformación es el mismo tanto si se realiza en un solo paso como en muchos.
Estos descubrimientos fueron anteriores a la primera ley de la termodinámica (1845). Ayudaron a los científicos a comprender esta ley.
Edward Diaz y Hess investigaron el calor específico y el calor latente. Joseph Black desarrolló el concepto de cambios de energía latente.
Gustav Kirchhoff demostró en 1858 que el cambio en el calor de reacción viene dado por la diferencia de capacidad calorífica entre los productos y los reactivos: ∂ Δ H ∂ T = Δ C p {{displaystyle {{partial \Delta H}} sobre {partial T}={Delta C_{p}}. \\N-sobre \N-parcial T}=\N-Delta C_{p}} 
Calorimetría
La medición de los cambios de calor se llama calorimetría. Mide el calor de las reacciones químicas o de los cambios físicos. Un calorímetro, un dispositivo para la calorimetría, suele ser una cámara cerrada.
La calorimetría tiene estos pasos: Los químicos hacen que el cambio se produzca dentro de la cámara. La temperatura de la cámara se mide con un termómetro o un termopar. La temperatura se representa en función del tiempo para obtener un gráfico. Los químicos utilizan el gráfico para calcular las magnitudes fundamentales.
Los calorímetros modernos tienen pequeños ordenadores que miden la temperatura y dan los datos calculados rápidamente. Un ejemplo es el calorímetro diferencial de barrido (DSC).
Sistemas
Varias definiciones termodinámicas son muy útiles en termoquímica. Un "sistema" es la sección específica del universo que se estudia. Todo lo que está fuera del sistema se considera el entorno o medio ambiente. Un sistema puede ser:
- un sistema aislado: cuando no puede intercambiar energía o materia con el entorno, como ocurre con un calorímetro de bomba aislado;
- un sistema cerrado: cuando puede intercambiar energía pero no materia con el entorno, como ocurre con un radiador de vapor;
- un sistema abierto: cuando puede intercambiar tanto materia como energía con el entorno, una olla de agua hirviendo, por ejemplo.
Procesos
Un sistema sufre un "proceso" cuando cambian una o varias de sus propiedades (características). Un proceso se relaciona (conecta) con el cambio de estado. Un proceso isotérmico (misma temperatura) ocurre cuando la temperatura del sistema permanece igual. Un proceso isobárico (misma presión) ocurre cuando la presión del sistema permanece igual. Un proceso adiabático (sin intercambio de calor) ocurre cuando no hay movimiento de calor.
Páginas relacionadas
- Publicaciones importantes en termoquímica
- Reacción isodérmica
- Principio de trabajo máximo
- Calorímetro de reacción
- Principio de Thomsen-Berthelot
- Julius Thomsen
- Bases de datos termodinámicas para sustancias puras
- Calorimetría
- Física térmica
Preguntas y respuestas
P: ¿Qué es la termoquímica?
R: La termoquímica es el estudio de la energía y el calor relacionados con las reacciones químicas y las transformaciones físicas.
P: ¿Cuáles son algunos ejemplos de transformaciones físicas?
R: Algunos ejemplos de transformaciones físicas son la fusión (cuando un sólido se convierte en líquido) y la ebullición (cuando un líquido se convierte en líquido).
P: ¿Cómo ayuda la termoquímica a predecir las cantidades de reactivo y producto?
R: Los termoquímicos utilizan datos, incluidas las determinaciones de entropía, para predecir las cantidades de reactante y producto en todo momento durante una reacción determinada.
P: ¿Las reacciones endotérmicas son favorables o desfavorables?
R: Las reacciones endotérmicas son desfavorables.
P: ¿Las reacciones exotérmicas son favorables o desfavorables?
R: Las reacciones exotérmicas son favorables.
P: ¿Qué conceptos combina la termoquímica?
R: La termoquímica combina los conceptos de la termodinámica con la idea de energía en forma de enlaces químicos.
P: ¿Qué tipos de cálculos realizan los termoquímicos?
R: Los termoquímicos realizan cálculos como la capacidad calorífica, el calor de combustión, el calor de formación, la entalpía, la entropía, la energía libre y las calorías.
Buscar dentro de la enciclopedia