Qué es la calorimetría diferencial de barrido (DSC) y sus aplicaciones
Descubre la calorimetría diferencial de barrido (DSC): principios y aplicaciones en materiales, polímeros, fármacos y alimentos para análisis térmico y control de calidad.
La calorimetría diferencial de barrido (DSC) es una técnica analítica termal ampliamente utilizada en las ciencias de los materiales, la termoquímica, el control de la pureza y la formulación de fármacos, así como en el aseguramiento de la calidad de alimentos y otros productos. El DSC mide cómo varía el flujo de calor hacia o desde una muestra con respecto a una referencia bien definida cuando se somete a un programa de temperatura controlado. Esta información permite identificar y cuantificar transiciones térmicas (por ejemplo, transición vítrea, fusión, cristalización, curado o desnaturalización), determinar entalpías y capacidades caloríficas, y estudiar cinéticas de reacciones térmicas. El DSC fue ideado por E.S. Watson y M.J. O'Neil en 1962 y presentado comercialmente por primera vez en 1963 en la conferencia de Química Analítica y Espectroscopia Aplicada celebrada en Pittsburgh.
Estructura física y principio de funcionamiento
Existen dos diseños básicos de DSC:
- DSC de flujo de calor: mantiene aproximadamente común la potencia suministrada al horno y mide la diferencia de temperatura entre el porta-muestras (con la muestra) y el porta-referencia (vacío o material inerte). La diferencia de temperatura se relaciona con la diferencia en flujo de calor.
- DSC de potencia compensada: mantiene constante la diferencia de temperatura entre muestra y referencia compensando la potencia eléctrica; la señal medida es la potencia necesaria para mantener esa igualdad térmica.
El diseño típico incluye: porta-muestras y porta-referencia (pequeños cráneos o cápsulas metálicas), un horno o baño calefactor con resistencia, termopares para medir la temperatura en cada celda y un sistema de control y registro. El calor fluye desde la resistencia hacia las cámaras de muestra y referencia; las pequeñas diferencias en flujo o potencia se registran como la señal DSC.
En muchos textos y equipos se hace referencia a una figura 1 que ilustra el montaje (horno, soportes, termopares y crucetas). Además de los diseños estándar, existen variantes modernas (por ejemplo, DSC modulada, micro-DSC o DSC de alta velocidad) que amplían las capacidades de análisis.
Eventos térmicos que puede detectar el DSC
- Transición vítrea (Tg): cambio en la capacidad calorífica sin liberación o absorción neta de calor latente.
- Fusión (melting): pico endotérmico con entalpía de fusión asociada.
- Cristalización: pico exotérmico si la muestra cristaliza al enfriarse o calentarse.
- Curado o reticulación de polímeros: picos exotérmicos que permiten cuantificar la entalpía de curado y el grado de conversión.
- Transiciones de fase y polimorfismo: cambios en la estructura cristalina o transiciones sólido–sólido.
- Desnaturalización de proteínas y fusión de biopolímeros: picos endotérmicos característicos.
- Oxidación o índices de estabilidad (OIT, OOT): determinación de la resistencia a la oxidación bajo atmósferas específicas.
- Medida de capacidad calorífica (Cp) y análisis termodinámico cuantitativo.
Interpretación de la señal y parámetros clave
Los parámetros principales que se extraen de un termograma DSC son:
- Temperatura de inicio u onset: punto donde comienza la desviación respecto de la línea base; útil para comparar temperaturas de transición.
- Temperatura de pico: máxima señal del evento (ej. máximo de fusión o desnaturalización).
- Área bajo el pico: integrada en unidades de energía (J) y, dividida por la masa de muestra, da la entalpía específica (J/g) del evento.
- Cambio en Cp: magnitud del salto en la línea base en la Tg, relacionado con la capacidad calorífica.
- Forma y ancho del pico: proporcionan información sobre la cinética del proceso y la heterogeneidad de la muestra.
Para obtener valores precisos se requiere una calibración periódica (por ejemplo usando materiales estándares como indio para entalpías y punto de fusión, y zafiro para Cp) y una corrección de línea base. La cinética aparente del proceso depende fuertemente de la velocidad de calentamiento; diferentes velocidades desplazan los onsets y picos.
Modos y variantes instrumentales
- DSC modulada (MDSC): superpone una pequeña oscilación de temperatura sobre la rampa media, permitiendo separar el flujo de calor reversible (asociado a Cp) del no reversible (cinéticos, crystallización rápida, curado).
- Fast DSC o micro-DSC: permite tasas de calentamiento/enfriamiento muy altas para estudiar procesos rápidos o simular condiciones reales de procesamiento.
- DSC de alta presión o con atmósfera controlada: permite trabajar con gases reactivos o presiones elevadas para estudiar oxidación u otras reacciones en condiciones específicas.
Preparación de muestras y condiciones experimentales
- Masa típica: desde microgramos a decenas de miligramos, dependiendo del equipo y sensibilidad.
- Tipo de cápsulas o crisol: aluminio (común), acero inoxidable, crisol hermético o sellado para muestras volátiles y sensibles al oxígeno.
- Atmósfera: nitrógeno o argón para condiciones inertes; aire o oxígeno para estudios de oxidación.
- Velocidad de calentamiento/enfriamiento: valores típicos 1–20 °C/min, aunque se emplean tasas mayores o menores según el objetivo. La elección influye en la resolución y la cinética aparente.
- Sellado adecuado para evitar pérdida de volátiles o reacciones con el ambiente; limpieza y homogeneidad de la muestra son críticas.
Aplicaciones prácticas
- Polímeros: determinación de Tg, entalpía de fusión y cristalización, grado de curado, estabilidad térmica y compatibilidad entre fases.
- Farmacéutica: identificación de formas polimórficas, estudios de estabilidad, determinación de pureza (método de Van’t Hoff aproximado mediante entalpía de fusión), y compatibilidad excipiente-fármaco.
- Alimentos: caracterización de grasas y aceites (perfil de fusión), evaluaciones de calidad y estabilidad, y análisis de procesos de cristalización.
- Biociencias: estudios de desnaturalización proteica, interacciones ligando-proteína y estabilidad de formulaciones biológicas (con micro-DSC o DSC de bajas masas).
- Materiales avanzados y metales: identificación de transiciones de fase, determinación de temperaturas críticas y estudios termodinámicos en aleaciones y cerámicos.
- Control de calidad y regulación: comprobación de lotes, especificaciones de proceso y garantía de reproducibilidad en fabricación.
Ventajas y limitaciones
- Ventajas: técnica rápida, relativamente sencilla de usar, proporciona información cuantitativa sobre entalpías y Cp, y es aplicable a un amplio rango de materiales.
- Limitaciones: no aporta información estructural directa (se complementa con técnicas como DSC + XRD o espectroscopía), la señal depende de la calidad del contacto térmico y del tamaño de muestra, y la interpretación puede verse afectada por eventos superpuestos y por la dependencia de la velocidad de calentamiento.
Calibración, control de calidad y seguridad
La calibración regular con estándares (indio, zinc, zafiro) y la verificación de la línea base son necesarias para resultados fiables. Es importante registrar condiciones experimentales completas (masa, tipo de crisol, atmósfera, velocidad) para poder reproducir y comparar datos. En cuanto a seguridad, manejar con cuidado los crisolados tras ensayos a alta temperatura, vigilar gases empleados y evitar sobrepresiones en cápsulas selladas.
En resumen, el DSC es una técnica esencial en el análisis térmico, capaz de ofrecer datos termodinámicos y cinéticos valiosos para investigación y control de calidad en múltiples industrias; su correcta aplicación requiere una buena preparación de muestras, calibración y entendimiento de las limitaciones instrumentales.
Teoría
El enfoque teórico más sencillo para entender el mecanismo de funcionamiento de los DSC se denomina modelo lineal simplificado y hace uso de las siguientes suposiciones:
- El flujo de calor es constante,
- No hay interacción entre la muestra y la referencia,
- Sólo se consideran las capacidades térmicas de la muestra y de la referencia,
- La temperatura que se mide es la temperatura actual de la muestra,
- El sistema está aislado del entorno, es decir, no hay intercambio de calor con el exterior.
La ley de Fourier de la conducción del calor, que es la ley fundamental que explica cómo se transfiere el calor a través de los materiales puede utilizarse para ver la relación entre la temperatura y el flujo de calor en el sistema. Esta ley establece que la cantidad de energía térmica que pasa a través de una pequeña porción de un área (A) de un material, que se llama densidad de flujo de calor y se denota por ( Φ A ) {\textstyle ({\frac {\mathsf {\Phi }}{\mathsf {A}})} 

Φ A = - k Δ T Δ x {\frac {\mathsf {\Phi }}=-k{{frac {{mathsf {\Delta }}T}{{{mathsf {\Delta }}x}
Generalmente, en el DSC se utiliza un ordenador para suministrar calor a un ritmo específico tanto en el soporte de referencia como en el de la muestra. Cuando el portamuestras contiene una sustancia mientras que la referencia se mantiene vacía, se produce un aumento o una disminución de la temperatura del portamuestras denotada por ( T s ) {\tstyle (T_{s})} 
- Si el proceso consume calor, es decir, se necesita calor externo para que se produzca el evento, lo que también se denomina endotérmico, entonces la temperatura en el portamuestras disminuye.
- Si el proceso es liberador de calor, es decir, se produce un calor extra, lo que también se denomina exotérmico, entonces la temperatura en el portamuestras aumenta.
Entonces, el cambio resultante en el flujo de calor debido a estas variaciones de temperatura se puede encontrar utilizando la ley de Fourier como la siguiente,
| Φ r | = k A Δ x | Δ T s r | {\displaystyle |{mathsf {\Phi }_{r}|={frac {kA}{\mathsf {\Delta }}x}|{{mathsf {\Delta }}|}
o
| Φ r | = K | Δ T s r | = { - K Δ T s r , : exotérmico K Δ T s r , : endotérmico {{displaystyle |{mathsf {\Phi }}_{r}|=K|{{mathsf {\Delta }}T_{sr}}={{cases}-K{\mathsf {\Delta }}T_{sr},&{text{: exotérmico}}K{\mathsf {\Delta}}T_{sr},&{texto{\mathsf}}: endotérmico}} {{casos}}
Por lo tanto, a partir de este sencillo modelo resulta que existe una proporcionalidad directa (K) entre el flujo de calor y las variaciones de temperatura de la muestra. Esta constante de proporcionalidad depende de la distancia de la pared a la muestra indicada como (Δx), del área de la sección transversal del soporte (A) y de la conductividad térmica (k). Generalmente, los principales resultados del experimento DSC es una señal de salida de la tasa de flujo de calor en función de la temperatura, que se denominan curvas DSC. El análisis de estas curvas desempeña un papel importante en la determinación del calor de transformación, el calor de las reacciones o cualquier cambio en la capacidad calorífica debido a las variaciones de temperatura, por ejemplo, la entalpía de los procesos exotérmicos y endotérmicos puede determinarse hallando el área bajo la curva DSC utilizando una técnica matemática llamada cálculo integral.
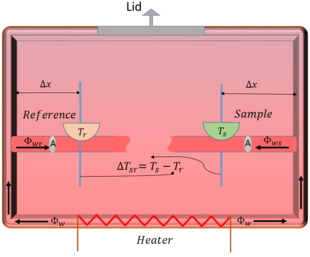
Figura 2. El dibujo esquemático con todas las variables asignadas para el análisis teórico.
Aplicaciones
Desnaturalización térmica de las proteínas
Una de las aplicaciones más importantes de la DSC está relacionada con el desdoblamiento térmico de las proteínas, un proceso denominado desnaturalización.El papel de la DSC en este proceso se utiliza para determinar el rango de temperatura en el que las proteínas presentan cambios estructurales. Además, cuando la solución de proteínas se trata bajo una tasa de calor constante y una presión constante, el DSC puede determinar las capacidades térmicas aparentes de las proteínas. De hecho, las proteínas desnaturalizadas resultan tener mayores capacidades térmicas y la detección adecuada de los cambios en ellas a lo largo del tiempo puede ayudar a averiguar el grado de desdoblamiento.
Evaluación de lípidos y grasas
El control de calidad de los alimentos es una de las cuestiones más importantes para el cuidado de la salud y el bienestar del ser humano. Se han denunciado muchas prácticas ilegales en relación con los productos alimentarios, concretamente la adulteración de algunos aceites y grasas vegetales de alto precio. La adulteración es una acción que consiste en mezclar ingredientes de baja calidad y a veces perjudiciales con productos alimentarios destinados a la venta. En este campo, el DSC se utiliza para analizar el comportamiento térmico de los lípidos principalmente mediante dos procesos, el de enfriamiento, que informa sobre la cristalización, y el de calentamiento, que da información sobre el comportamiento de fusión de los componentes básicos de los lípidos. La adulteración en las grasas o aceites modifica las curvas de enfriamiento y calentamiento del DSC. Por ejemplo, aparecen nuevos picos y los existentes sufren cambios. Por lo tanto, el análisis de los datos del DSC puede utilizarse para estimar el proceso de adulteración de los nutrientes.
Pureza de la droga
El DSC ha ganado bastante interés en la investigación de la pureza de los fármacos porque requiere muestras con poca cantidad (1-2 mg) y es considerablemente rápido en términos de tiempo de análisis. Por ejemplo, controlando los efectos de las sustancias extrañas, se puede averiguar hasta qué punto un fármaco es puro. Resulta que las impurezas disminuyen la temperatura de fusión ( T m ) {\displaystyle (T_{m})} 

Preguntas y respuestas
P: ¿Qué es la calorimetría diferencial de barrido?
R: La calorimetría diferencial de barrido (DSC) es una herramienta de análisis ampliamente utilizada en las ciencias de los materiales, la termoquímica, la pureza de los fármacos y las pruebas de calidad de los alimentos.
P: ¿Qué tipo de información proporciona la DSC?
R: La DSC proporciona información instantánea sobre las características termodinámicas que desempeñan un papel importante en la comprensión de procesos complejos durante la formación de sustancias.
P: ¿En qué áreas puede aplicarse la DSC?
R: El DSC puede aplicarse a las ciencias de los materiales, la termoquímica, la pureza de los fármacos y las pruebas de calidad de los alimentos.
P: ¿Quién inventó el DSC?
R: El DSC fue inventado por E.S. Watson y M.J. O'Neil en 1962.
P: ¿Cuándo se comercializó el DSC?
R: El DSC se comercializó en 1963 en la conferencia de Química Analítica y Espectroscopia Aplicada celebrada en Pittsburgh.
P: ¿Cuáles son algunos ejemplos de procesos complejos que el DSC puede ayudar a comprender?
R: Por ejemplo, el DSC puede ayudar a comprender la reticulación de polímeros, el intercambio de calor debido al plegado y desplegado de proteínas o el mecanismo de formación de ADN de cadena simple o doble.
P: ¿Cuáles son algunas de las ventajas de la DSC?
R: Algunas de las ventajas del DSC son su rapidez y facilidad de manejo, ya que proporciona información instantánea sobre las características termodinámicas.
Buscar dentro de la enciclopedia


