Tinción en microscopía: definición, colorantes y técnicas en histología
Tinción en microscopía: definición, colorantes y técnicas de histología para mejorar contraste y visualizar células y tejidos, métodos in vivo e in vitro para diagnóstico e investigación
La tinción se utiliza en microscopía para que las células y los tejidos sean más fáciles de ver y comprender.
Es una forma de mejorar el contraste en la imagen microscópica. Las tinciones y los colorantes se utilizan a menudo en biología y medicina para resaltar las estructuras de los tejidos biológicos, a menudo con la ayuda de diferentes microscopios.
La tinción puede realizarse en tejidos vivos (in vivo) o en tejidos muertos (in vitro).
¿Qué es la tinción y cuál es su principio?
La tinción consiste en aplicar uno o varios colorantes que se unen con distinta afinidad a componentes celulares (núcleo, citoplasma, fibras, mucopolisacáridos, etc.) para generar contraste. Los colorantes pueden ser básicos (cationes) que tiñen componentes ácidos como el ADN y los ribosomas (p. ej. hematoxilina), o ácidos (aniones) que prefieren componentes básicos como proteínas citoplasmáticas (p. ej. eosina). Otros principios importantes incluyen la metacromasia (cambio de color según concentración o unión; ej. toluidina azul), el uso de mordientes para fijar colorantes y la especificidad por afinidad química o inmunológica.
Tipos de colorantes y ejemplos comunes
- Tinción general o de rutina: Hematoxilina y eosina (H&E) — resalta núcleos (azulado) y citoplasma/matriz (rosado).
- Tinciones especiales: PAS (ácido Schiff periódico) para carbohidratos y mucinas; Tricrómico de Masson para distinguir músculo, colágeno y fibrillas; Azul de Alcian para mucopolisacáridos ácidos.
- Tinciones para microbios: Gram (bacterias Gram +/−), Ziehl–Neelsen (bacilos ácido-alcohol resistentes como Mycobacterium), Giemsa/Wright (parasitos y frotis sanguíneos).
- Tinciones de impregnación: Plata/silver stains para fibras reticulares, neuronas y hongos.
- Técnicas inmunohistoquímicas (IHC): uso de anticuerpos dirigidos a antígenos específicos; detectores cromogénicos (DAB) o fluorescentes.
- Fluorocromos y microscopía de fluorescencia: DAPI (ADN), FITC, Alexa Fluor, TRITC — permiten marcaje múltiple y co-localización.
- Tinciones vitales: colorantes usados en tejidos o células vivas, p. ej. trypan blue (excluido por células viables), fluoresceína para estudios vasculares.
Técnicas habituales en histología y citología
- Hematoxilina y eosina (H&E): la más usada en anatomía patológica para evaluación general.
- Tinciones especiales: se emplean según la sospecha clínica (mucinas, lípidos, mielina, fibras elásticas, etc.).
- Inmunohistoquímica (IHC): para detectar proteínas específicas mediante anticuerpos; requiera a menudo recuperación antigénica y controles positivos/negativos.
- Inmunofluorescencia: indicada para localización subcelular y co-marcaje; puede realizarse en tejidos o células fijadas.
- Hibridación in situ (ISH): para localizar secuencias de ADN/ARN en cortes tisulares.
- Frotis y extendidos: coloración tipo Romanowsky (Giemsa/Wright) en hematología y parasitología.
Protocolo general en tinción histológica (pasos clave)
- Fijación: conserva la morfología (p. ej. formol 10%).
- Procesado y embebido: deshidratación, aclaramiento y embutición en parafina o congelación para criocortes.
- Corte: se obtienen secciones finas (microtomía) o cortes congelados.
- Desparafinización y rehidratación: antes de aplicar colorantes sobre cortes de parafina.
- Tinción: aplicación de colorantes y, si procede, pasos de diferenciación y lavado.
- Deshidratación, aclaramiento y montaje: preparar el portaobjetos para su observación y conservación.
- Controles: incluir controles técnicos y biológicos para asegurar especificidad y calidad.
Aplicaciones prácticas
- Diagnóstico en anatomía patológica (tumores, inflamación, necrosis).
- Identificación de microorganismos y su clasificación.
- Investigación celular y molecular (localización de proteínas o ácidos nucleicos).
- Evaluación de la viabilidad celular y estudios funcionales en vivo con tinciones vitales.
Controles, artefactos y limitaciones
La calidad del resultado depende de la fijación, del control del tiempo de tinción, de la calidad de los reactivos y de la técnica. Entre los artefactos comunes se encuentran: tinción desigual, desprendimiento de secciones, precipitados del colorante y pérdida antigénica. Es esencial incluir controles positivos y negativos, además de validar protocolos nuevos.
Seguridad y gestión de residuos
Muchos colorantes y disolventes son tóxicos o irritantes; algunos son potencialmente carcinogénicos. Se debe usar equipo de protección personal (guantes, gafas, campana), seguir las hojas de datos de seguridad (MSDS) y las normas del laboratorio para la eliminación de residuos líquidos y sólidos.
Consejos y resolución básica de problemas
- Si los núcleos no se tiñen bien, verifique la fijación y el pH de la hematoxilina.
- Si hay fondo excesivo, aumente los lavados o reduzca el tiempo de tinción.
- Para tinciones inmunohistoquímicas débiles, optimice la recuperación antigénica, la concentración del anticuerpo y los tiempos de incubación.
- Mantenga lotes de reactivos y controles documentados para reproducibilidad.
En resumen, la tinción en microscopía es una herramienta esencial para visualizar y distinguir componentes celulares y tisulares. La elección del colorante y la técnica dependerá del objetivo (diagnóstico, investigación, microbiología) y requiere protocolos controlados, controles adecuados y buenas prácticas de seguridad.
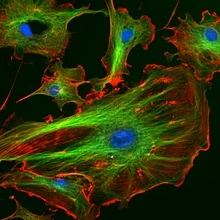
Microscopía de vanguardia: Los núcleos se tiñen de azul con DAPI, los microtúbulos se marcan en verde con un anticuerpo y los filamentos de actina se etiquetan en rojo con faloidina

Un montaje típico de un microscopio. Una muestra teñida en un portaobjetos de vidrio se monta en la platina de un microscopio
Preparación
El tejido muerto necesita ser "fijado" para que no se descomponga. El fijador mantiene la estructura tal como es. Tras la fijación, el tejido puede cortarse en rodajas finas y colocarse en una serie de portaobjetos de cristal. En ocasiones, es necesario disolver las membranas celulares para que las grandes moléculas de colorante puedan entrar en las células. Las normas se publican en la revista Biotechnic & Histochemistry.
Tinción
La forma más sencilla es sumergir el portaobjetos más el espécimen en una solución de colorante, luego enjuagarlo y examinarlo. Los tintes utilizados son tintes certificados, probados por la Comisión de Tintes Biológicos.
Bacterias de tinción
La tinción de Gram se utiliza para clasificar las bacterias. Se basa en la composición de su pared celular. La tinción de Gram utiliza cristal violeta para teñir las paredes celulares, yodo como mordiente y una contratinción que marca todas las bacterias.
Las bacterias Gram positivas se tiñen de azul oscuro o violeta. Su pared celular carece de la membrana secundaria y de la capa de lipopolisacáridos de las bacterias Gram negativas.
En la mayoría de las preparaciones con tinción de Gram, los organismos Gram negativos son de color rojo o rosa por la contratinción.
Tinción de tejidos
La tinción con hematoxilina y eosina se utiliza a menudo en histología para secciones finas de tejido. La hematoxilina tiñe de azul los núcleos celulares, mientras que la eosina tiñe de rosa o rojo el citoplasma, el tejido conectivo y otras sustancias extracelulares.
La eosina es fuertemente absorbida por los glóbulos rojos, coloreándolos de un rojo intenso. En una preparación de H&E bien hecha, los glóbulos rojos son casi anaranjados, y el colágeno y el citoplasma (especialmente el muscular) adquieren diferentes tonos de rosa. La hematoxilina tiñe de azul el núcleo de la célula y otras estructuras ácidas (como las partes ricas en ARN del citoplasma y la matriz del cartílago hialino). En cambio, la eosina tiñe de rosa el citoplasma y el colágeno.
Una tinción rápida y sencilla que se utiliza en los frotis de sangre y en las células de la mejilla humana es el azul de metileno, que tiñe los núcleos. Hay muchas otras tinciones especializadas, algunas fluorescentes bajo una luz especial.
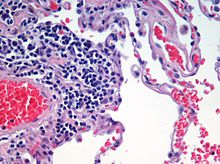
Vista microscópica de una muestra histológica de tejido pulmonar humano teñida con hematoxilina y eosina
Buscar dentro de la enciclopedia