Ósmosis: qué es, cómo funciona y su importancia en las células
Ósmosis: descubre qué es y cómo el movimiento de agua a través de membranas regula la presión osmótica y mantiene la turgencia y función vital de las células.
La ósmosis (/ɒzˈmoʊ.sɪs/) es el movimiento neto de moléculas de disolvente (normalmente agua) a través de una membrana semipermeable desde una región de mayor concentración de disolvente (menor concentración de solutos) hacia otra de menor concentración de disolvente (mayor concentración de solutos), sin intervención de una fuerza externa. En español puede pronunciarse /osˈmosis/.
¿Cómo funciona?
La ósmosis se debe al movimiento aleatorio (difusión) de las moléculas de disolvente y a la permeabilidad selectiva de la membrana: la membrana permite el paso del disolvente pero limita o impide el paso de ciertas moléculas de soluto. Como consecuencia, el disolvente tiende a desplazarse hasta equilibrar las concentraciones relativas en ambos lados de la membrana. Cuando no hay balance, se observa un flujo neto de disolvente en una sola dirección.
Es útil distinguir entre ósmosis y difusión: la difusión es el movimiento neto de cualquier especie (soluto o disolvente) por gradiente de concentración, mientras que la ósmosis se refiere específicamente al movimiento del disolvente a través de una membrana semipermeable en presencia de solutos que no atraviesan la membrana.
Presión osmótica
La presión osmótica es la presión externa que debe aplicarse para impedir el movimiento neto de disolvente a través de la membrana. En términos prácticos, se puede considerar como la "fuerza" que ejerce una solución concentrada para atraer solvente. La presión osmótica depende de la concentración de partículas disueltas; en soluciones diluidas puede aproximarse por la ley de Van ’t Hoff:
- π = i M R T
donde π es la presión osmótica, i es el coeficiente de disociación del soluto (número efectivo de partículas por fórmula unitaria), M la concentración molar del soluto, R la constante de los gases y T la temperatura absoluta. En soluciones reales y a altas concentraciones se requieren correcciones.
Tonicidad: efectos sobre las células
El efecto de una solución sobre una célula depende de la relación entre las concentraciones interiores y exteriores de solutos (tonicidad):
- Solución isotónica: no hay movimiento neto de agua; la célula mantiene su volumen.
- Solución hipotónica (externa): el medio exterior tiene menor concentración de solutos que el interior celular; el agua entra en la célula por ósmosis, pudiendo producir hinchazón y, en células animales, lisis (estallido).
- Solución hipertónica (externa): el medio exterior tiene mayor concentración de solutos; el agua sale de la célula y esta se encoge (plasmólisis en células vegetales, crenación en células animales).
Ósmosis en membranas biológicas
Las membranas celulares son semipermeables: suelen ser impermeables a moléculas grandes como iones cargados, proteínas y polisacáridos, y relativamente permeables a moléculas no polares o pequeñas como gases (O2, CO2), lípidos y ciertos solutos no cargados. La permeabilidad depende de la solubilidad en lípidos, la carga y el tamaño molecular.
El transporte de agua a través de la membrana plasmática puede ocurrir de dos maneras:
- Por difusión simple a través de la bicapa de fosfolípidos.
- Por canales especializados llamados acuaporinas, que facilitan un flujo de agua más rápido y regulado según las necesidades celulares.
Importancia biológica
La ósmosis es crucial en numerosos procesos biológicos:
- Células vegetales: la entrada de agua por ósmosis mantiene la presión de turgencia, que sostiene los tejidos y permite que las plantas permanezcan erguidas. La vacuola central y la pared celular evitan la lisis aun cuando la célula toma gran cantidad de agua.
- Células animales: deben mantener un equilibrio osmótico con su entorno; cambios bruscos de tonicidad pueden dañar las células, por eso organismos multicelulares regulan los fluidos corporales.
- Osmorregulación: organismos como peces, protozoos y bacterias emplean mecanismos (válvulas, bombas iónicas, vacuolas contráctiles) para controlar la entrada y salida de agua y solutos.
- Sistema renal en animales: los riñones usan principios osmóticos para concentrar la orina, reabsorber agua y mantener la homeostasis de electrolitos y volumen sanguíneo.
Aplicaciones tecnológicas y experimentales
La ósmosis tiene aplicaciones prácticas y demostraciones experimentales:
- Ósmosis inversa: proceso usado en desalinización y purificación de agua donde se aplica presión mayor que la presión osmótica para forzar el paso de agua a través de una membrana en sentido contrario, separando el agua pura de los solutos.
- Mediciones de presión osmótica: experimentos con tubos en U y membranas semipermeables permiten medir el flujo de agua y la presión necesaria para detenerlo.
- Medicina: elección de soluciones intravenosas (isotónicas, hipotónicas o hipertónicas) debe considerar los efectos osmóticos sobre las células del paciente.
Riesgos y consideraciones
Un cambio abrupto en la tonicidad del líquido extracelular puede causar choque osmótico, con pérdida de función celular o muerte. Por ello, en medicina y biotecnología es fundamental controlar gradientes osmóticos y la velocidad de cambios en la concentración de solutos.
Resumen
En resumen, la ósmosis es un fenómeno físico-químico fundamental que regula el movimiento de disolvente a través de membranas semipermeables, controla el volumen celular y la presión de turgencia en plantas, y tiene aplicaciones prácticas como la ósmosis inversa y la terapia médica. La presión osmótica y la permeabilidad membranares, incluida la acción de las acuaporinas, determinan la magnitud y dirección del flujo osmótico.
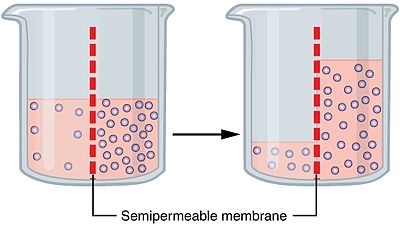
El proceso de ósmosis sobre una membrana semipermeable. Los puntos azules representan las partículas que impulsan el gradiente osmótico
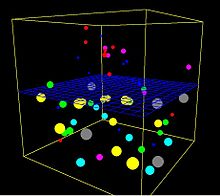
Esta es una toma de una simulación tridimensional por ordenador del proceso de ósmosis. La malla azul es impermeable a las bolas más grandes, pero las más pequeñas pueden pasar. Todas las bolas están rebotando
Hipotónico, isotónico e hipertónico
Las soluciones pueden tener más o menos soluto por unidad de disolvente. La que tiene menos se llama hipotónica. Cuando las dos soluciones tienen igual concentración, son isotónicas. La que tiene más es hipertónica. Cuando la solución hipotónica está fuera de la célula y la hipertónica dentro, la célula se hincha y se deforma.
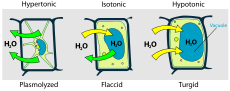
La célula vegetal en diferentes entornos
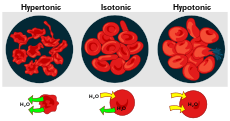
Efecto de diferentes soluciones en las células sanguíneas
Membranas celulares
La membrana plasmática de una célula es semipermeable, lo que significa que permite la entrada o salida de ciertas moléculas. Deja pasar a las moléculas pequeñas, pero bloquea a las más grandes. La membrana también tiene puertos o puertas que hacen pasar ciertas macromoléculas. Se trata de un transporte activo, que utiliza energía y es selectivo. Es la cubierta más externa de la célula animal, hecha de proteínas y lípidos. Ejemplo: intercambio de gases como el oxígeno y el dióxido de carbono.
Páginas relacionadas
- Ósmosis inversa
- Osmorregulación
Preguntas y respuestas
P: ¿Qué es la ósmosis?
R: La ósmosis es el movimiento de moléculas de disolvente (líquido) a través de una membrana, de una solución a otra, sin una fuerza exterior. El disolvente se desplazará hacia el lado con mayor concentración de solutos y menor concentración de disolvente.
P: ¿Cómo funciona la ósmosis?
R: La ósmosis funciona porque la membrana es selectivamente permeable, permitiendo el paso del disolvente pero no del soluto. Las moléculas de disolvente se mueven al azar y así las concentraciones en ambos lados se igualan. Se puede aplicar una presión osmótica para que no haya un movimiento neto de disolvente a través de la membrana.
P: ¿Qué factores afectan a la permeabilidad en las membranas biológicas?
R: La permeabilidad en las membranas biológicas depende de la solubilidad, la carga o la química, así como del tamaño del soluto.
P: ¿Cómo viajan las moléculas de agua a través de las membranas biológicas?
R: Las moléculas de agua viajan a través de las membranas biológicas mediante la difusión a través de la bicapa de fosfolípidos.
P: ¿Qué papel desempeña la ósmosis en los sistemas vivos?
R: En los sistemas vivos, la ósmosis proporciona una vía para que el agua entre y salga de las células y ayuda a mantener la presión de turgencia dentro de las células creando un equilibrio entre el interior de la célula y su entorno.
P: ¿Cómo afecta la concentración molar a la presión osmótica?
R: La presión osmótica depende de la concentración molar del soluto; las concentraciones más altas requieren más presión externa para que no haya un movimiento neto de disolvente a través de la membrana.
Buscar dentro de la enciclopedia