Alótropos del carbono: propiedades y usos de diamante, grafito y más
Alótropos del carbono: descubre propiedades y usos del diamante, grafito y otros, desde joyería y abrasivos hasta conductividad y aplicaciones industriales.
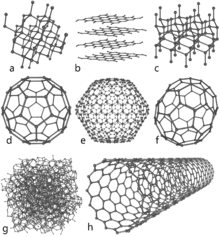
Existen varios alótropos del carbono. El diamante y el grafito son los más conocidos, pero también existen otras formas importantes como el grafeno (una sola lámina de átomos de carbono), los fullerenos (esferas moleculares como las "buckyballs"), los nanotubos de carbono y el carbono amorfo (hollín, carbón vegetal). Cada una de estas formas tiene propiedades físicas y químicas muy distintas aunque estén hechas únicamente por átomos de carbono.
El grafito es un buen ejemplo de cómo cambia el comportamiento según la estructura: es un conductor eléctrico y térmico en el plano de sus capas, y en conjunto se clasifica a veces como semimetal (un caso intermedio entre un metal y un no metal, similar a materiales como el fósforo negro o el selenio gris). Por eso se utiliza, por ejemplo, como material en los electrodos de lámparas de arco eléctrico y en muchas aplicaciones eléctricas e industriales. El grafito es además la forma más estable de carbono sólido conocida bajo condiciones estándar de temperatura y presión.
Los alótropos son formas diferentes de un mismo elemento químico. Todos los elementos están formados únicamente por sus propios átomos, pero las diferencias físicas y químicas entre alótropos se deben a la forma en que se unen esos átomos y cómo se organizan las moléculas o redes para formar estructuras más grandes. En el caso del carbono, la posibilidad de hibridaciones sp3, sp2 y sp permite enlaces tetraédricos (como en el diamante), planos (como en el grafito y el grafeno) o lineales, lo que explica la enorme diversidad de propiedades.
Propiedades destacadas
- Durez: El diamante es el mineral natural más duro conocido, gracias a su red covalente tetraédrica (hibridación sp3). Esto lo convierte en un excelente abrasivo y en material para herramientas de corte.
- Conductividad: Mientras el diamante es buen aislante eléctrico, el grafito conduce bien la electricidad en las direcciones paralelas a sus capas por la movilidad de electrones π. El grafeno, derivado del grafito, presenta una conductividad excepcional y propiedades electrónicas novedosas.
- Conductividad térmica: El diamante y el grafeno muestran conductividades térmicas muy altas; por eso se investigan para gestionar el calor en electrónica de alta potencia.
- Óptica: El diamante tiene un índice de refracción elevado y una alta dispersión de la luz, lo que le da brillo y fuego en joyería. Además mantiene muy bien su brillo con el pulido adecuado.
- Estabilidad térmica: Tanto el diamante como el grafito tienen puntos de sublimación o fusión extremadamente altos —algo poco común en elementos no metálicos— y su estabilidad depende de la presión y la presencia de oxígeno.
- Otras propiedades: Los fullerenos y nanotubos presentan propiedades mecánicas, eléctricas y químicas únicas que los hacen útiles en nanomateriales y composites.
Usos y aplicaciones
Las aplicaciones varían según el alótropo:
- Diamante: Joyería y uso industrial como abrasivo, discos de corte, brocas y herramientas de precisión. También se emplea en óptica y en electrónica de alta potencia por su conductividad térmica.
- Grafito: lubricante sólido, electrodos (por ejemplo, en hornos eléctricos y en baterías), materiales refractarios y componentes en la industria nuclear y metalúrgica.
- Grafeno y nanotubos: investigación en electrónica flexible, sensores, refuerzo de composites, almacenamiento de energía (supercondensadores y baterías) y aplicaciones biomédicas.
- Fullerenos: estudios en química médica, catalizadores y materiales electrónicos.
Obtención y síntesis
Algunos alótropos se encuentran en la naturaleza (p. ej., diamantes naturales y grafito), mientras que otros se producen artificialmente o se purifican para usos específicos. Métodos comunes:
- Diamante sintético por alta presión y alta temperatura (HPHT) o por deposición química de vapor (CVD).
- Grafeno obtenido por exfoliación mecánica del grafito, crecimiento por CVD o reducción de óxidos de grafeno.
- Nanoestructuras (nanotubos, fullerenos) fabricadas por descargas de arco, láser o métodos químicos.
Seguridad y medio ambiente
En general, las formas macroscópicas como el diamante o el grafito son estables y de bajo riesgo. Sin embargo, algunos nanomateriales de carbono (nanotubos, nanopartículas de carbono) requieren precauciones en su manejo: pueden ser respirables y tener efectos sobre la salud si se inhalan en altas concentraciones, por lo que es importante el control de polvo, ventilación y equipos de protección. También hay consideraciones sobre el ciclo de vida y reciclaje de materiales compuestos que contienen carbono.
En resumen, los alótropos del carbono muestran cómo un mismo elemento, mediante distintas formas de enlace y ordenamiento atómico, da lugar a materiales con propiedades muy diversas y aplicaciones que van desde la joyería y los abrasivos hasta la electrónica avanzada y la nanotecnología. La comprensión de su estructura explica por qué, por ejemplo, el diamante es extremadamente duro y el grafito es buen conductor, y sigue abriendo nuevas posibilidades tecnológicas.
size=0.56
Preguntas y respuestas
P: ¿Qué son los alótropos del carbono?
R: Los alótropos del carbono son formas diferentes del mismo elemento químico.
P: ¿Cuáles son los alótropos más famosos del carbono?
R: Los alótropos más famosos del carbono son el diamante y el grafito.
P: ¿Qué es el grafito y cuáles son sus propiedades?
R: El grafito es un semimetal y un buen conductor. También es la forma más estable de carbono sólido jamás descubierta.
P: ¿Qué son los alótropos?
R: Los alótropos son formas diferentes de un mismo elemento químico.
P: ¿Por qué los distintos elementos muestran alotropía?
R: Muchos elementos muestran alotropía porque hay varias formas en las que los átomos pueden unirse entre sí.
P: ¿Qué es el diamante y cuáles son sus propiedades?
R: El diamante es uno de los alótropos del carbono más conocidos. Su dureza y alta dispersión de la luz lo hacen adecuado para su uso en joyería. También es el mineral natural más duro conocido.
P: ¿Cuál es el punto de fusión tanto del diamante como del grafito?
R: Tanto el diamante como el grafito tienen puntos de fusión extremadamente altos, lo que es inusual para un elemento no metálico.
Buscar dentro de la enciclopedia