Isótopos del hidrógeno: definición y tipos — protio, deuterio, tritio
Descubre los isótopos del hidrógeno: definición, características y diferencias entre protio, deuterio y tritio, su estabilidad y aplicaciones.
El hidrógeno tiene tres isótopos principales: protio (1H), deuterio (2H) y tritio (3H). Estos isótopos se encuentran de forma natural. El protio y el deuterio son estables; el tritio es radiactivo y tiene una vida media de aproximadamente 12,32 años. Los científicos han creado además otros cuatro isótopos más pesados (H4–H7), pero estos son muy inestables y no existen de forma natural.
¿Qué es un isótopo?
Un isótopo de un elemento químico tiene el mismo número de protones en el núcleo (por eso sigue siendo hidrógeno: 1 protón) pero distinto número de neutrones. Esa diferencia en el número de neutrones produce variaciones en la masa atómica y en algunas propiedades físicas y nucleares, aunque las propiedades químicas sean muy parecidas en muchos casos.
Composición nuclear de los isotopos del hidrógeno
- Protio (1H): 1 protón y 0 neutrones. Es el isótopo más abundante del hidrógeno.
- Deuterio (2H o D): 1 protón y 1 neutrón. Es estable y aproximadamente el 0,015% del hidrógeno natural.
- Tritio (3H o T): 1 protón y 2 neutrones. Es radiactivo, con una vida media de ~12,32 años; se produce en cantidades muy pequeñas de forma natural (por rayos cósmicos) y en reactores nucleares o por reacciones de neutrones.
Abundancia y origen
El protio constituye la gran mayoría del hidrógeno en la Tierra (≈99,98–99,99%). El deuterio aparece en proporciones muy pequeñas (unos 156 partes por millón, ≈0,0156%). El tritio es extremadamente raro en la naturaleza; la mayor parte del tritio existente se genera por procesos artificiales o por interacción de rayos cósmicos con la atmósfera.
Notación y nombres
Además de la notación isotópica con el número de masa (AH), el Unión Internacional de Química Pura y Aplicada (IUPAC) recomienda el uso de 1H, 2H y 3H para identificar los isotopos. Los nombres tradicionales deuterio y tritio y los símbolos abreviados D y T siguen usándose ampliamente en la literatura y en aplicaciones prácticas.
Propiedades y efectos isotópicos
- Las diferencias de masa entre isotopos afectan algunas propiedades físicas: por ejemplo, el agua pesada (D2O) tiene puntos de ebullición y fusión ligeramente mayores que el agua normal (H2O).
- En química y bioquímica existe el efecto isotópico cinético: las reacciones que implican ruptura de enlaces con hidrógeno pueden variar su velocidad si el hidrógeno es deuterio en vez de protio.
- En espectroscopía, el deuterio y el tritio se usan para identificar y rastrear moléculas (marcaje isotópico).
Aplicaciones
- Deuterio: se emplea en forma de agua pesada (D2O) como moderador en algunos reactores nucleares, en experimentos de espectroscopía (NMR), y como trazador en estudios químicos y geológicos.
- Tritio: utilizado en radiomarcadores, en iluminación auto-luminosa (relojes, señales), en investigación como trazador radioactivo y como posible combustible en reacciones de fusión (fusión D–T).
Isótopos inestables H‑4 a H‑7
Los isótopos más pesados del hidrógeno (H4, H5, H6, H7) han sido producidos en experimentos en aceleradores. Son extremadamente inestables y existencias efímeras: decaen casi inmediatamente (medidas en fracciones muy pequeñas de segundo) por emisión de neutrones u otros procesos nucleares, por lo que no se encuentran en la naturaleza de forma estable.
Seguridad y medio ambiente
El tritio, al ser un emisor beta de baja energía, presenta un riesgo externo limitado (la radiación no penetra la piel con facilidad), pero la ingestión, inhalación o absorción puede representar un riesgo radiológico interno. Por ello, su manejo en laboratorios e instalaciones nucleares sigue normas de seguridad específicas para evitar su liberación y exposición.
Resumen: El hidrógeno tiene tres isotopos principales —protio, deuterio y tritio— con propiedades y aplicaciones distintas. Mientras el protio y el deuterio son estables y de uso amplio en ciencia e industria, el tritio es radiactivo y se emplea con precaución en aplicaciones nucleares e investigativas. Otros isotopos más pesados han sido observados en laboratorio pero son altamente inestables.
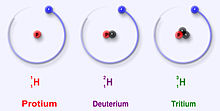
Los tres isótopos más estables del hidrógeno
Protio (hidrógeno-1)
El protio es el isótopo más común del hidrógeno. Constituye más del 99,98% de todo el hidrógeno del universo. Se llama protio porque su núcleo sólo tiene un protón. El protio tiene una masa atómica de 1,00782504(7) u. El símbolo del protio es 1H.El protón del procio nunca ha decaído en una observación, por lo que los científicos creen que el procio es un isótopo estable. Las nuevas teorías de la física de partículas predicen que el protón puede desintegrarse, pero esta desintegración es muy lenta. Se dice que el protón tiene una vida media de 1036 años. Si la desintegración del protón es cierta, entonces todos los demás núcleos que se dicen estables son en realidad sólo estables desde el punto de vista de la observación, es decir, parecen estables. Experimentos recientes han demostrado que si la desintegración del protón se produce, tendría una vida media de 6,6 × 1033años.
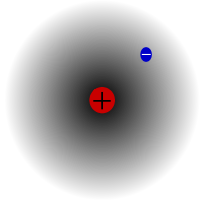
El protio, el isótopo más común del hidrógeno. Es especial porque es el único isótopo que no tiene neutrones.
Deuterio (hidrógeno-2)
El deuterio, o 2H o a veces D, es otro isótopo estable del hidrógeno. Este isótopo tiene un protón y un neutrón. Constituye alrededor del 0,0026 - 0,0184% de todos los átomos de hidrógeno de la Tierra. El deuterio está menos presente en el gas hidrógeno de la Tierra y más en el agua de mar (0,015% o 150 ppm). El deuterio no es radiactivo y no daña a los seres vivos. El deuterio también puede formar moléculas de agua. El agua que tiene deuterio en lugar de protio se llama agua pesada.
Tritio (hidrógeno-3)
El tritio ( 3H) es el radioisótopo más estable del hidrógeno. Es decir, de todos los isótopos radiactivos del hidrógeno, el tritio es el menos radiactivo. Tiene un protón y 2 neutrones en su núcleo. El tritio se desintegra por desintegración beta menos y se transforma en helio-3. Tiene una vida media de 12,32 años.El tritio se forma de forma natural por la interacción entre los gases de la atmósfera superior y los rayos cósmicos. También se crea durante las pruebas de armas nucleares. El tritio y el deuterio se utilizan en la fusión nuclear D-T en las estrellas para dar mucha energía.
Preguntas y respuestas
P: ¿Cuántos isótopos principales de hidrógeno existen?
R: Existen tres isótopos principales del hidrógeno: el protio, el deuterio y el tritio.
P: ¿Son el protio y el deuterio isótopos estables?
R: Sí, el protio y el deuterio son isótopos estables.
P: ¿Cuál es la vida media del tritio?
R: El tritio es radiactivo y tiene una vida media de unos 12 años.
P: ¿Cuántos otros isótopos de hidrógeno han creado los científicos?
R: Los científicos han creado otros cuatro isótopos de hidrógeno: del 4H al 7H.
P: ¿Existen de forma natural estos cuatro isótopos de hidrógeno adicionales?
R: No, estos isótopos son muy inestables y no existen de forma natural.
P: ¿Qué hace que los isótopos principales del hidrógeno sean únicos?
R: Los isótopos principales del hidrógeno son únicos porque son los únicos isótopos que tienen un nombre.
P: ¿Tienen el deuterio y el tritio sus propios símbolos?
R: Sí, el deuterio y el tritio tienen a veces sus propios símbolos: D y T. Sin embargo, a la Unión Internacional de Química Pura y Aplicada no le gustan mucho estos nombres, aunque se utilizan a menudo.
Buscar dentro de la enciclopedia