Tioles (mercaptanos): qué son, propiedades y uso como odorante
Tioles (mercaptanos): conoce su estructura, olor intenso, propiedades químicas y por qué se usan como odorantes en gas natural, además de sus riesgos y aplicaciones.
Un tiol es una molécula que contiene un grupo funcional R‑SH. Los tioles, también llamados mercaptanos, son análogos de los alcoholes en los que el átomo de oxígeno se ha sustituido por uno de azufre. Esa sustitución cambia varias propiedades físicas y químicas: los tioles suelen tener olores muy intensos y desagradables, son menos polares que los alcoholes y no forman enlaces de hidrógeno tan fuertes, por lo que su solubilidad en agua y sus puntos de ebullición difieren de los alcoholes de peso molecular similar.
Propiedades químicas
Los tioles son más ácidos que los alcoholes: sus pKa típicos se sitúan alrededor de 10–11 frente a los ~16–18 de los alcoholes, de modo que una base moderada puede desprotonarlos formando el anión tiolato (RS−). El tiolato es un nucleófilo fuerte y “blando”, muy reactivo en reacciones de sustitución nucleofílica (SN2) y en adiciones a dobles enlaces activados.
Otra característica importante es su alta facilidad para oxidarse. Bajo condiciones suaves dos moléculas de tiol se oxidan para dar un disulfuro (R–S–S–R), reacción clave en química y en biología: por ejemplo, dos residuos de cisteína en una proteína pueden formar un enlace disulfuro que estabiliza su estructura. Además, los tioles forman complejos fuertes con metales pesados (mercurio, oro, plata), razón por la que tradicionalmente se les llamó “mercaptanos” (del latín que alude a su capacidad de capturar mercurio).
Propiedades físicas y olor
Muchos tioles tienen olores extremadamente penetrantes incluso a concentraciones muy bajas (umbral de olor en rangos de partes por billón o menores). Esta característica hace que los tioles y compuestos sulfurados relacionados sean responsables de olores desagradables en la descomposición orgánica, en el hedor de algunas plantas y animales (por ejemplo, en la defensa de la mofeta) y en gases que, de otro modo, serían inodoros.
Usos importantes
- Odorización de gases: Como el metano y otros componentes del gas natural son inodoros, se añaden pequeñas cantidades de tioles u otros compuestos sulfurados para que el público perciba fugas. Entre los tioles empleados con este fin están el metantiol, el etantiol y derivados terciarios (por ejemplo, tert-butilmercaptano), además de otros compuestos azufrados como tioéteres y tiófenos según normativa y zona.
- Química orgánica: Se usan como nucleófilos (mediante la formación de tiolatos), como precursores en síntesis de tióteres (R–S–R’) y para obtener disulfuros. También están presentes en procesos de protección/desprotección de grupos funcionales.
- Biología y bioquímica: El aminoácido la cisteína contiene un grupo tiol; este grupo es esencial en la catálisis de muchas enzimas (por ejemplo, proteasas de cisteína) y en moléculas antioxidantes como el glutatión.
Reacciones típicas
- Oxidación: 2 R–SH → R–S–S–R (formación de disulfuro)
- Desprotonación: R–SH + base → R–S− + H+ (formación de tiolato, nucleófilo)
- Sustitución nucleofílica y formación de tióéteres: R–S− + R'–X → R–S–R' (SN2)
- Formación de complejos metálicos: los tiolatos coordinan fuertemente a metales blandos
Seguridad y manejo
Aunque se añaden en cantidades muy pequeñas como odorantes, los tioles son inflamables, malolientes y algunos pueden ser tóxicos a concentraciones más altas. En laboratorio deben manipularse en una campana extractora, con guantes y gafas de seguridad. Los controles de calidad en la industria del gas incluyen detectar y dosificar cuidadosamente estas sustancias para garantizar la detectabilidad sin riesgos innecesarios para la salud.
En resumen, los tioles (o mercaptanos) son compuestos sulfurados con un grupo funcional R‑SH que combinan propiedades físicas y reactivas particulares: son más ácidos y más fácilmente oxidable que los alcoholes, forman tiolatos nucleofílicos y disulfuros, desempeñan papeles clave en la bioquímica (p. ej. la cisteína) y se utilizan técnicamente como odorantes para detectar fugas de gas natural para que la gente pueda olerlo, ya que el metano por sí mismo no tiene olor pero puede explotar muy fácilmente.
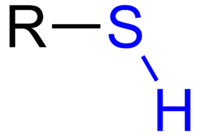
Fórmula general de un tiol
Buscar dentro de la enciclopedia