Miosinas: proteínas motoras ATPasa en eucariotas para la contracción muscular
Miosinas: proteínas motoras ATPasa en eucariotas que usan ATP para la contracción muscular. Descubre estructura, función y diversidad genética conservada entre especies.
Las miosinas son un grupo de proteínas especializadas que se utilizan para la contracción y el movimiento muscular en las células eucariotas. Las miosinas necesitan ATP como energía para realizar estas funciones. Se ha descubierto un gran número de genes de miosina diferentes en los eucariotas.
La estructura y la función de la miosina están muy conservadas en todas las especies. Por ejemplo, la miosina II del músculo del conejo se unirá a la actina de una ameba.
Estructura general y mecanismo motor
Las miosinas tienen una arquitectura típica con tres regiones principales:
- Cabeza (dominio motor): región que une actina y ATP, posee actividad ATPasa y convierte la energía química en movimiento mecánico.
- Cuello o palanca: una zona rígida con motivos IQ que se asocian a cadenas ligeras (light chains), que actúan como amplificadores del pequeño cambio conformacional de la cabeza.
- Cola: determina la oligomerización (formación de dímeros o filamentos) y la interacción con cargas o membranas; sus variaciones explican la diversidad funcional entre clases de miosina.
El ciclo mecánico-químico básico (ciclo de puentes cruzados) incluye pasos bien caracterizados: unión de ATP a la cabeza de miosina, disociación de actina, hidrólisis de ATP (ADP + Pi) que "carga" la cabeza, unión débil/ fuerte a la actina, liberación de Pi que desencadena el golpe mecánico (power stroke) y finalmente la liberación de ADP. Este ciclo se repite y produce el deslizamiento de filamentos de actina respecto a miosina.
Clases y funciones celulares
Existen muchas clases de miosinas (I, II, V, VI, etc.), cada una adaptada a funciones concretas:
- Miosina II: responsable de la contracción en músculo estriado y liso; forma filamentos bipolares que permiten el deslizamiento de actina (teoría del filamento deslizante).
- Miosina I: monomérica, participa en la regulación de la membrana plasmática, formación de micropliegues y tracción de vesículas en células no musculares.
- Miosina V: dímera procesiva que transporta orgánulos y vesículas a lo largo de filamentos de actina a distancias relativamente largas.
- Miosina VI, XV, etc.: especializadas en funciones como transporte, anclaje o procesos sensoriales (por ejemplo, algunas están implicadas en la audición y en la organización de estereocilios).
Regulación
La actividad de las miosinas se regula de varias maneras:
- Calcio y troponina-tropomiosina: en el músculo estriado, el aumento de Ca2+ provoca cambios en el complejo troponina-tropomiosina, permitiendo que la miosina se una a la actina.
- Fosforilación de la cadena ligera reguladora: en muchas miosinas no musculares o en músculo liso, la fosforilación por quinasas (p. ej. MLCK) activa la capacidad de formar puentes cruzados.
- Interacciones con proteínas accesorias: proteínas adaptadoras, pequeñas GTPasas y otras modifican la localización, la formación de filamentos y la actividad motora.
Conservación evolutiva y diversidad genética
El dominio motor de la miosina está altamente conservado entre eucariotas, lo que permite ejemplos como el mencionado: la miosina II del músculo del conejo puede interactuar funcionalmente con la actina de una ameba. Sin embargo, las regiones de cola varían mucho entre clases y especies, dando lugar a la gran diversidad de genes de miosina y a sus múltiples funciones celulares.
Importancia biológica y clínica
Las miosinas son esenciales para procesos como la contracción muscular, la citocinesis (formación del anillo contráctil), el transporte intracelular de orgánulos, la migración celular y el mantenimiento de la forma celular. Mutaciones en genes de miosina están asociadas a enfermedades humanas, por ejemplo cardiomiopatías familiares, trastornos del movimiento y ciertos defectos sensoriales.
Resumen
En conjunto, las miosinas son motores moleculares dependientes de ATP que, mediante una estructura cabeza-cuello-cola y un ciclo de hidrólisis de ATP, generan fuerzas y desplazamientos sobre filamentos de actina. Su motor está conservado en eucariotas, mientras que la diversidad de colas y módulos accesorios explica la amplia gama de funciones celulares que desempeñan.
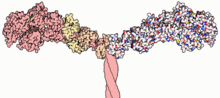
Parte de la estructura de la miosina II
Estructura y función
Piezas
La mayoría de las moléculas de miosina se componen de una parte de cabeza, una parte de cuello y una parte de cola.
- La parte de la cabeza se agarra a la actina y utiliza la energía del ATP para tirar, haciendo que el músculo se acorte.
- la parte del cuello actúa como una palanca.
- La parte de la cola interactúa principalmente con otras moléculas u otras subunidades de miosina. En algunos casos, la parte de la cola puede ayudar a regular el movimiento.
Carrera de fuerza
Muchas moléculas de miosina pueden hacer que los músculos se acorten utilizando la energía liberada al descomponer las moléculas de ATP en ADP y un grupo fosfato. La carrera de fuerza se produce cuando un fosfato que se ha roto se libera de la miosina. Esto hace que la miosina cambie de forma para tirar de la actina. Cuando la molécula de ADP se libera y una nueva molécula de ATP se une a la cabeza de la miosina, la cabeza se libera de la actina. La miosina rompe el nuevo ATP y el ciclo continúa. El efecto combinado de todos los golpes de fuerza de las diferentes moléculas de miosina hace que el músculo se acorte.
Buscar dentro de la enciclopedia