Principio isolobal: definición, fundamentos y aplicaciones organometálicas
Principio isolobal: definición, fundamentos y aplicaciones organometálicas. Descubre cómo la analogía isolobal predice enlaces, reactividad y guía el diseño de nuevos compuestos organometálicos.
El principio isolobal (también conocido como analogía isolobal) es una herramienta conceptual para predecir las propiedades de enlace y la reactividad de fragmentos moleculares, especialmente en los compuestos organometálicos. En la química organometálica relaciona la estructura de los ligandos orgánicos con fragmentos inorgánicos que pueden unirse a un mismo sitio de reacción. Según Roald Hoffmann, dos fragmentos son isolobales "si el número, las propiedades de simetría, la energía aproximada y la forma de los orbitales de frontera y el número de electrones en ellos son similares, no idénticos, pero sí similares". En la práctica, si dos fragmentos tienen orbitales frontera comparables (HOMO y LUMO), la forma en que forman enlaces y su reactividad pueden ser análogas, permitiendo predecir el comportamiento de un fragmento poco conocido a partir de uno bien estudiado. Los compuestos isolobales son conceptualmente análogos a los compuestos isoelectrónicos, que comparten el mismo número de electrones de valencia y una estructura semejante. En la Figura 1 se suele representar gráficamente las parejas isolobales mediante flechas que conectan los medios orbitales correspondientes.
Fundamentos conceptuales
El criterio isolobal se apoya en la teoría de orbitales moleculares y puede resumirse en unos puntos clave:
- Orbitales frontera: Se comparan la cantidad, la simetría, la forma y la energía relativa de los orbitales cercanos al nivel de ocupación (HOMO y LUMO).
- Conteo de electrones: Fragmentos con números de electrones comparables suelen ser candidatos a ser isolobales; aquí la contabilización (reglas de 18 electrones, clasificación LX/X, etc.) ayuda a situar al fragmento.
- Tipo de donación/aceptación: Si un fragmento es principalmente donador σ, o además acepta por retrodonación π, esto influye en su analogía con otro fragmento.
- Simetría y degeneración: La correspondencia entre las representaciones de simetría de los orbitales es esencial para que la analogía sea útil en la predicción de enlaces con otros fragmentos.
Aplicaciones prácticas en organometálicos
El principio isolobal se utiliza de manera amplia como guía cualitativa en investigación y enseñanza. Algunas aplicaciones típicas son:
- Diseño y predicción de complejos: Permite proponer estructuras de complejos metálicos análogas a moléculas orgánicas conocidas, facilitando hipótesis sobre geometrías y enlaces.
- Racionalización de reactividad: Al comparar fragmentos isolobales se pueden entender reacciones de acoplamiento, adición u oxidación/reducción en términos análogos a reacciones orgánicas.
- Ingeniería de catalizadores: Ayuda a modificar ligandos o sitios activos sustituyendo fragmentos por otros isolobales para ajustar la actividad y selectividad catalítica.
- Construcción de clusters y agregados: La relación isolobal facilita la predicción de cómo se ensamblan fragmentos metálicos y orgánicos en estructuras más grandes.
- Educación y comunicación: Ofrece un lenguaje intuitivo para conectar química orgánica y metal-ligando, útil en la enseñanza de química organometálica.
Ejemplos ilustrativos
Con fines didácticos, suele decirse que ciertos radicales orgánicos, carbenos o fragmentos metileno pueden ser "equivalentes" a fragmentos metálicos que presentan orbitales frontera de forma y energía similares. Por ejemplo, un radical metilo (•CH3) o un carbocatión pueden mostrar un comportamiento análogo al de ciertos fragmentos metálicos con un orbital frontal singular, en cuanto a la formación de enlaces y la reactividad hacia nucleófilos o radicales. Estas comparaciones ayudan a transferir intuiciones de la química orgánica a la organometálica, aunque siempre conviene comprobar con cálculos y estudios experimentales.
Limitaciones y precauciones
Hoffmann mismo advertía que la analogía isolobal es un modelo útil pero simplificado. Sus limitaciones incluyen:
- Simplificación orbital: Se fija en los orbitales frontera y puede obviar efectos importantes de orbitales más internos, polaridad y repulsiones electrostáticas.
- Energetics y ambiente químico: Pequeñas diferencias en energía entre orbitales o la presencia de ligandos fuertemente π-aceptores/ donadores pueden invalidar la analogía.
- Estados electrónicos y multiconfiguracionales: En sistemas con estados electrónicos complejos o con acoplamientos magnéticos importantes, la correspondencia isolobal puede fallar.
- Factores estéricos y dinámicos: La forma espacial y la flexibilidad influyen en la reactividad real, y no siempre quedan reflejadas en una comparación isolobal pura.
Contexto histórico y reconocimiento
Por su contribución a desarrollar y popularizar la analogía isolobal, Roald Hoffmann recibió el Premio Nobel de Química en 1981, que compartió con Kenichi Fukui. En su discurso de aceptación Hoffmann subrayó la utilidad didáctica y predictiva del modelo, a la vez que recordó sus límites y la necesidad de apoyarlo con datos experimentales y cálculos teóricos.
En resumen, el principio isolobal es una herramienta conceptual potente para conectar la química orgánica y la organometálica, ofrecer intuiciones sobre enlaces y reactividad, y orientar el diseño de nuevos complejos. No obstante, debe emplearse como punto de partida complementado con análisis cuantitativos (cálculos de orbitales moleculares, conteo electrónico y estudios experimentales) cuando se requiera exactitud predictiva.
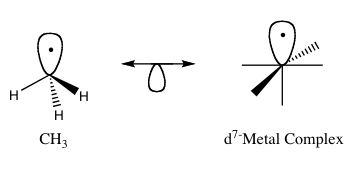
Figura 1: Ejemplo básico de la analogía isolobal.
Preguntas y respuestas
P: ¿Qué es el principio isolobal?
R: El principio isolobal (también conocido como analogía isolobal) es una forma de predecir las propiedades de enlace de los compuestos organometálicos. Relaciona la estructura de los ligandos orgánicos que pueden unirse a fragmentos moleculares inorgánicos comparando su orbital molecular de mayor ocupación (HOMO) y su orbital molecular de menor desocupación (LUMO).
P: ¿Quién propuso el principio isolobal?
R: Roald Hoffmann propuso el principio isolobal.
P: ¿Qué relación tiene con los compuestos isoelectrónicos?
R: Los compuestos isolobales son análogos a los compuestos isoelectrónicos que comparten el mismo número de electrones de valencia y la misma estructura.
P: ¿Qué recibió Hoffmann por su trabajo sobre este concepto?
R: Por su trabajo sobre la analogía isolobal, Hoffmann recibió el Premio Nobel de Química en 1981, que compartió con Kenichi Fukui.
P: ¿Cómo describió Hoffmann los fragmentos moleculares?
R: Hoffmann describió los fragmentos moleculares como isolobales "si el número, las propiedades de simetría, la energía aproximada y la forma de los orbitales frontera y el número de electrones en ellos son similares - no idénticos, pero similares".
P: ¿Cómo se utiliza este modelo para predecir el enlace y la reactividad?
R: Se puede predecir la unión y la reactividad de una pieza menos conocida a partir de la de una pieza más conocida si tienen orbitales de frontera similares.
P: ¿Funciona siempre correctamente este modelo?
R: No, falla en ciertos casos.
Buscar dentro de la enciclopedia