Espectroscopia ultravioleta-visible
La absorción ultravioleta-visible es un proceso en el que una molécula absorbe luz ultravioleta o visible que excita los electrones (los hace de alta energía). Esta energía provoca una transición electrónica de un estado básico (no excitado) a un estado excitado.
Se utiliza en una técnica de espectroscopia de absorción conocida como espectroscopia UV-visible.
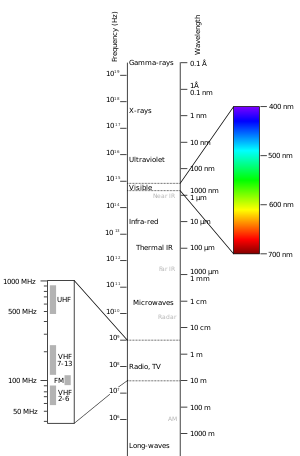
El espectro electromagnético
Absorción de energía
Diferentes moléculas absorben diferentes longitudes de onda de la luz. Las longitudes de onda de la luz para la absorción UV-visible van de unos 200 nanómetros a 800 nanómetros. Esta es una sección del espectro electromagnético ilustrada.
La absorción de la luz comienza con la exposición de la energía de una determinada longitud de onda en esta región UV-visible a una molécula. La luz/energía excita entonces los electrones exteriores o de valencia del estado básico (no excitado) a un estado excitado (alta energía). El resultado de esto se puede medir con un espectrofotómetro de UV-visible. Los datos se muestran como un espectro con la absorción frente a la longitud de onda. Este patrón puede utilizarse para conocer las propiedades de la molécula. Sólo algunas moléculas pueden absorber la luz en esta región.
Cromóforos
Las moléculas que absorben la luz en estas longitudes de onda se denominan cromóforos. Los cromóforos son grupos funcionales de una molécula que absorben la luz en esta región UV-Visible. La mayoría de las veces se caracterizan por tener electrones pi deslocalizados. Los electrones pi se refieren a un tipo de enlace que se produce entre orbitales de electrones llamados orbitales pi. Cuando existen muchos de estos enlaces pi en una molécula, esto permite que los electrones estén deslocalizados o repartidos por la molécula. A continuación se muestra un ejemplo de este tipo de molécula. Muchos tintes (moléculas coloreadas) se caracterizan por estos electrones pi deslocalizados y su color. Estas moléculas pueden utilizarse como indicadores de pH para determinar si una solución es ácida o básica. La adición de ácido o base interrumpe los electrones pi deslocalizados. Esta alteración provoca un cambio de color.

Polvo de tornasol
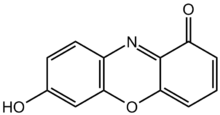
Estructura química de la 7-hidroxifenoxazona, el cromóforo de los componentes del tornasol
Ley de la Cerveza
La absorción de una molécula puede utilizarse para determinar la concentración de la molécula en la solución. Para hallar la concentración se utiliza la ley de Beer. Se trata de una relación matemática que se muestra en la siguiente ecuación.
A = a b c {\desde el estilo A=abc}
A= absorción, a=coeficiente de absorción, b=longitud de recorrido, c=concentración
Los componentes de la Ley de Beer pueden determinarse mediante pruebas. También se pueden consultar en la literatura. Si la absorción se mide con un espectrofotómetro UV-visible (instrumento para medir la absorción y la longitud de onda de las moléculas), la longitud de la trayectoria (b) está relacionada con el recipiente de la muestra utilizado en la prueba. El recipiente de la muestra (denominado cubeta) está hecho de un material que no absorbe la luz en esta región. El grosor de esta cubeta es un valor conocido. Esta es la longitud del camino que la luz recorrerá para llegar a la muestra. El coeficiente de absorción molar puede calcularse midiendo la absorción de una muestra de concentración y longitud de recorrido conocidas. Las unidades del coeficiente de absorción dependen de la longitud de recorrido y de las unidades de concentración. Las unidades de absorción molar son L mol-1 cm-1 cuando las unidades de concentración son la molaridad. La absorbencia es una medida de la intensidad con la que una molécula absorbe la luz en una determinada longitud de onda. Una vez determinada esta constante, se pueden determinar las concentraciones desconocidas a partir de esta relación.

Espectrofotómetro Beckman DU640 UV/Vis.
Buscar dentro de la enciclopedia
