Tricloruro de bismuto (BiCl3): definición, propiedades y usos
Tricloruro de bismuto (BiCl3): definición, propiedades y usos. Conoce su estructura, reactividad, aplicaciones industriales y pautas de seguridad del bismuto en estado +3.
El cloruro de bismuto (III), también conocido como tricloruro de bismuto, es un compuesto químico. Su fórmula química es BiCl3. Contiene iones de bismuto y cloruro. El bismuto se encuentra en su estado de oxidación +3.
Descripción y aspecto físico
El tricloruro de bismuto es un sólido cristalino que suele presentarse de color blanco a amarillo pálido. Es un compuesto covalente polar que, al exponerse a la humedad, se hidroliza liberando cloruro de hidrógeno y formando productos básicos del bismuto (por ejemplo, óxidos o oxicloruros como BiOCl).
Estructura y propiedades químicas
- Estado de oxidación: Bi(III), con un par de electrones no compartidos en el átomo de Bi que influencia su geometría.
- Geometría molecular: la unidad monomérica tiene tendencia a una geometría trigonal piramidal por la presencia del par solitario en Bi.
- Hidrolisis: reacciona con agua: BiCl3 + H2O → BiOCl + 2 HCl (y con exceso de agua pueden formarse otros productos básicos).
- Comportamiento ácido: actúa como ácido de Lewis, formando complejos con bases y con iones cloruro (por ejemplo, especies clorobismutas en medios ricos en cloruro).
- Masa molar aproximada: ~315,3 g·mol−1 (Bi ≈ 208,98 u + 3 × Cl ≈ 35,45 u).
Obtención y reacciones comunes
- Preparación: puede obtenerse por cloración directa del metal bismuto con cloro gaseoso o por tratamiento de óxidos/carbonatos de bismuto con ácido clorhídrico, seguido de aislamiento del haluro.
- Reacciones: además de la hidrólisis descrita, BiCl3 forma complejos con haluros y ligandos donantes (eteres, aminas). Se emplea como precursor en la síntesis de otros compuestos de bismuto (óxidos, sulfuros, materiales cerámicos).
Usos y aplicaciones
- Reactividad en síntesis orgánica: se utiliza como catalizador o reactivo de Lewis en reacciones orgánicas (por ejemplo, acilaciones, esterificaciones, algunas transformaciones de sustitución) donde se busca una catálisis suave y menos tóxica que la de algunos haluros de aluminio o cloruros de metales pesados.
- Precursor industrial y de laboratorio: sirve para preparar otros compuestos de bismuto utilizados en electrónica, cerámica y materiales funcionales.
- Investigación: se emplea en química inorgánica y de materiales para obtener fases de bismuto para estudios eléctricos, catalíticos o fotónicos.
- Nota: el tricloruro de bismuto no es lo mismo que los compuestos bismutatos usados en medicina (por ejemplo, el subsalicilato de bismuto), aunque algunos derivados de bismuto preparados a partir de BiCl3 pueden tener aplicaciones farmacéuticas bajo formulaciones específicas.
Seguridad y manejo
- BiCl3 es corrosivo y puede liberar HCl al reaccionar con la humedad; provoca irritación ocular, respiratoria y cutánea. Aunque las sales de bismuto suelen tener menor toxicidad que muchos metales pesados, el tricloruro debe manejarse con precaución.
- Usar siempre equipo de protección personal adecuado: guantes, gafas, bata y extracción por campana o sistema de ventilación. Evitar inhalación y contacto directo.
- En caso de derrame, aislar la zona, neutralizar con soluciones diluidas de bicarbonato si procede y recoger el residuo sólido para eliminación según la normativa local de residuos peligrosos.
- Almacenamiento en lugar seco, bien cerrado y alejado de agentes oxidantes y de humedad.
Disposición y normativa
La eliminación debe realizarse conforme a la legislación local y nacional sobre residuos químicos peligrosos. No verter en desagües sin tratamiento. Los envases contaminados deben gestionarse como residuos peligrosos.
Referencias y notas
El tricloruro de bismuto es un compuesto de interés tanto en química inorgánica como en química aplicada. Para aplicaciones específicas (puntos de fusión, solubilidad cuantitativa en distintos disolventes, constantes de equilibrio de complejos, etc.) conviene consultar fichas técnicas (MSDS) y literatura especializada según la necesidad experimental.
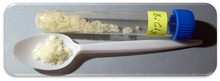
Cloruro de bismuto (III)
Propiedades
El cloruro de bismuto (III) es un sólido amarillo pálido. Reacciona con el agua para formar oxicloruro de bismuto y ácido clorhídrico. Se disuelve en ácidos como el clorhídrico. Reacciona con agentes reductores para formar bismuto metálico.
Preparación
Se fabrica haciendo reaccionar el bismuto con el cloro. También puede fabricarse disolviendo óxido de bismuto (III) en ácido clorhídrico. El bismuto puede disolverse en ácido nítrico para obtener nitrato de bismuto (III), que reacciona con cloruro de sodio para obtener cloruro de bismuto (III).
Utiliza
Se utiliza como catalizador en la química orgánica. Es una buena fuente de bismuto y se utiliza para fabricar otros compuestos de bismuto.
Seguridad
El cloruro de bismuto (III) puede causar quemaduras en la piel porque produce ácido clorhídrico al reaccionar con el agua. Irrita el tracto gastrointestinal.
Páginas relacionadas
- Bromuro de bismuto (III)
- Bismutina
Buscar dentro de la enciclopedia