Trióxido de selenio (SeO3): definición, propiedades y usos
Descubre qué es el trióxido de selenio (SeO3): propiedades, estructura, reactividad, riesgos y aplicaciones industriales y laboratoriales. Guía clara y actualizada.
El trióxido de selenio, también conocido como óxido de selenio (VI) y óxido selénico, es un compuesto químico. Su fórmula química es SeO3 . Contiene selenio en su estado de oxidación +6. También contiene iones de óxido.
Definición y naturaleza química
SeO3 es el anhídrido del ácido selénico (H2SeO4) y, por tanto, se clasifica como un óxido ácido. En presencia de agua reacciona fácilmente para formar H2SeO4:
SeO3 + H2O → H2SeO4
Propiedades físicas y químicas
- Apariencia: generalmente se encuentra como sólido cristalino de color blanco a blanquecino.
- Carácter químico: óxido ácido y agente oxidante; reacciona vigorosamente con agua y bases para formar selenatos.
- Solubilidad: reacciona con agua formando ácido selénico soluble; sus derivados (selenatos) son solubles en agua.
- Estructura: en fase gaseosa puede existir como molécula trigonal plana (análogo a SO3), mientras que en fase sólida suele presentarse en formas poliméricas con enlaces oxígeno-bridging entre átomos de Se.
- Estado de oxidación: el selenio está en el estado +6, el más oxidado de los estados comunes del selenio.
Estructura y reactividad
Como anhídrido de un ácido fuerte (H2SeO4), SeO3 es muy reactivo con agua y bases. Con bases forma el ion selenato (SeO42–) y sales de selenato. Es un agente oxidante que, en condiciones adecuadas, puede oxidar metales y compuestos orgánicos sensibles.
Obtención y métodos de preparación
- Se puede obtener por deshidratación del ácido selénico (por ejemplo, calentando H2SeO4 o mediante agentes desecantes) formando SeO3 como producto de eliminación de agua.
- En laboratorio también puede prepararse mediante oxidación controlada de compuestos de selenio en presencia de agentes oxidantes fuertes, cuidando las condiciones para evitar descomposición o formación de otros óxidos.
Usos
- Principalmente se emplea como intermedio en la preparación de ácido selénico y sales de selenato.
- En química orgánica y síntesis inorgánica se utiliza en algunos procedimientos como agente oxidante o fuente de especies de selenio en estado +6.
- Su uso industrial es limitado debido a su reactividad y a los riesgos toxicológicos asociados a los compuestos de selenio en altos niveles.
Seguridad y toxicidad
- Toxicidad: los compuestos de selenio pueden ser tóxicos; la exposición excesiva provoca selenosis con síntomas gastrointestinales, respiratorios y neurológicos. La inhalación de polvo o vapores de SeO3 y la ingestión son peligrosas.
- Corrosividad: SeO3 al hidratarse forma ácido selénico, que es corrosivo para tejidos y materiales.
- Medidas de protección: manipular en campana extractora, usar guantes resistentes a químicos, protección ocular y ropa de protección. Contar con procedimientos para derrames y exposición accidental.
Manejo, almacenamiento y eliminación
- Almacenar en recipientes herméticos, secos y en lugar bien ventilado, lejos de humedad y de agentes reductores o materiales combustibles.
- Evitar contacto con agua durante el almacenamiento. Tras derrames, neutralizar y recoger conforme a la normativa local sobre residuos peligrosos.
- La eliminación debe realizarse según la legislación vigente, habitualmente mediante gestión como residuo químico peligroso por empresas autorizadas.
Impacto ambiental
Los selenatos derivados (SeO42–) son solubles y pueden movilizarse en medios acuáticos; en concentraciones elevadas resultan tóxicos para organismos acuáticos y pueden bioacumularse. Por ello, el manejo y vertido de compuestos que contengan SeO3 requieren control para evitar contaminación.
Observaciones finales
El trióxido de selenio es un compuesto químico reactivo y útil como precursores de sales de selenio en estado +6, pero su manipulación exige precauciones estrictas por su reactividad con el agua y su toxicidad. En muchos contextos su uso está restringido a entornos de laboratorio con medidas de seguridad adecuadas.
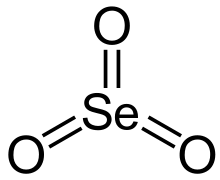
Estructura del trióxido de selenio
Propiedades
El trióxido de selenio es un sólido blanco. Se evapora fácilmente. Se disuelve fácilmente en agua. No es estable y se descompone en dióxido de selenio y oxígeno cuando se calienta. Es un potente agente oxidante, como todos los selenatos. Se disuelve en agua para formar ácido selénico.
Preparación
Puede fabricarse haciendo reaccionar selenato de potasio con dióxido de azufre. También puede hacerse deshidratando (eliminando el agua) el ácido selénico con un desecante fuerte, como el óxido de fósforo (V).
Páginas relacionadas
- Cloruro de selenio (I)
Buscar dentro de la enciclopedia