Hidrazina (N2H4): definición, propiedades y aplicaciones
Hidrazina (N2H4): descubre su definición, propiedades, usos industriales y aplicaciones científicas, riesgos y medidas de seguridad esenciales.
La hidracina, también conocida como diazina, es un compuesto químico. Está formado por iones de nitrógeno e hidrógeno. Su fórmula química es N2 H4 . Contiene hidrógeno en su estado de oxidación +1 y nitrógeno en su estado de oxidación -2.
Aclaración terminológica. El nombre común más usado en español es hidrazina (a veces escrito erróneamente como “hidracina” en textos antiguos). El término sistemático en inglés es diazane, que corresponde a la misma molécula N2H4. En este artículo utilizaremos “hidrazina” para referirnos a N2H4.
Descripción y estructura
La hidrazina (N2H4) es una molécula de pequeño tamaño formada por dos átomos de nitrógeno unidos por un enlace sencillo N–N, cada uno de ellos enlazado a dos átomos de hidrógeno. Es una base débil y un agente reductor potente. En condiciones normales se encuentra como un líquido incoloro con olor similar al del amoníaco y es completamente miscible con agua.
Propiedades físicas y químicas
- Estado físico: líquido incoloro (puede ser corrosivo y fumante en impurezas).
- Punto de ebullición: alrededor de 113–115 °C (pureza y presión afectan el valor).
- Punto de fusión: cercano a 2 °C (la hidrazina anhidra es sensible a la temperatura).
- Densidad: próxima a 1 g·cm⁻³ para la hidrazina anhidra; las disoluciones (hidrazina hidratada) tienen densidades variables.
- Solubilidad: miscible con agua y muchos solventes polares.
- Reactividad: fuerte agente reductor: reacciona con oxidantes (p. ej. permanganato, peróxidos) de forma vigorosa. Forma hidrazonas con aldehídos y cetonas y complejos con metales. Su descomposición es exotérmica y puede ser explosiva si se calienta o contamina con catalizadores.
Síntesis industrial
Existen varios procesos industriales para producir hidrazina. Entre los más relevantes están:
- Proceso de Raschig y variantes: basados en la reacción entre amoníaco y compuestos clorados (hipoclorito) para formar cloraminas que, al reaccionar con amoníaco, generan hidrazina. Históricamente muy utilizado pero con subproductos clorados.
- Proceso del peróxido (proceso moderno): utiliza peróxidos y una cetona (p. ej. acetona) para formar intermediarios (azines) que se hidrolizan liberando hidrazina y regenerando la cetona. Es más selectivo y genera menos subproductos indeseables.
Aplicaciones principales
- Propulsión espacial: la hidrazina y sus derivados (hidrazina monóhidrato, monometilhidrazina) se han usado como propelentes líquidos en cohetes y motores de maniobra debido a su comportamiento hipergólico con ciertos oxidantes y por su capacidad como monopropelente en presencia de un catalizador.
- Agente reductor y reactivo químico: en síntesis orgánica para reducir compuestos C=O (mediante formación de hidrazonas y posterior descomposición) y para producir diversos compuestos nitrogenados.
- Tratamiento de calderas y agua: la hidrazina se usa como inhibidor de la corrosión en calderas industriales porque consume oxígeno disuelto (reducción de O2) y forma capas protectoras en metales.
- Industria farmacéutica y agroquímica: como intermediario en la síntesis de fármacos, herbicidas y otros productos químicos.
- Producción de polímeros y agentes espumantes: en reacciones donde se requieren precursores nitrogenados o iniciadores específicos.
Seguridad y riesgos para la salud
La hidrazina es altamente tóxica y peligrosa. Sus principales riesgos son:
- Toxicidad aguda: por inhalación, ingestión o absorción cutánea puede causar irritación de ojos y vías respiratorias, náuseas, vómitos, daño hepático y renal, convulsiones y, en exposiciones altas, la muerte.
- Riesgo crónico: la exposición prolongada se ha asociado con daños en el hígado, sistema nervioso central y posibles efectos carcinogénicos; por ello numerosas agencias reguladoras limitan su manipulación y exposición ocupacional.
- Inflamabilidad y reactividad: aunque no es extremadamente inflamable, reacciona violentamente con oxidantes y puede descomponerse de forma explosiva bajo ciertas condiciones o en presencia de catalizadores (metales, sales).
Medidas de protección: manipular en campana extractora, usar guantes resistentes a productos químicos, protección ocular, ropa protectora y, si es necesario, respirador adecuado. Almacenarla alejada de oxidantes, fuentes de calor y materiales incompatibles.
Medio ambiente y eliminación
La hidrazina es tóxica para organismos acuáticos y su liberación al medio ambiente debe evitarse. En soluciones acuosas se oxida relativamente rápido, pero aun así requiere tratamiento controlado. La eliminación se realiza generalmente mediante oxidación controlada seguida de tratamiento de efluentes; los desechos deben gestionarse conforme a la legislación local y nacional.
Detección y análisis
En laboratorio y control industrial, la hidrazina puede detectarse y cuantificarse por métodos como cromatografía (tras derivatización), espectrofotometría colorimétrica, electroquímica e instrumentación GC–MS o LC–MS tras métodos adecuados de preparación de muestra. Para monitoreo ocupacional existen detectores portátiles y tubos colorimétricos específicos.
Almacenamiento y transporte
- Almacenar en recipientes herméticos, en lugar fresco y ventilado, lejos de fuentes de ignición y materiales incompatibles.
- Usar recipientes y tuberías resistentes a la corrosión y evitar metales que catalicen su descomposición.
- Durante el transporte cumplir la normativa de sustancias peligrosas aplicable (embalaje, etiquetado, documentación).
Regulación
Debido a su toxicidad y su uso en aplicaciones militares y aeroespaciales, la producción, comercialización y uso de hidrazina está regulada en muchos países. Es importante consultar las guías y límites de exposición ocupacional, hojas de seguridad (SDS) y la normativa local para su manipulación y eliminación.
Si necesita información más técnica (fórmulas espectroscópicas, procedimientos de descomposición controlada, límites de exposición en su país o fichas de seguridad), indíquelo y puedo proporcionarla o buscar las referencias normativas pertinentes.
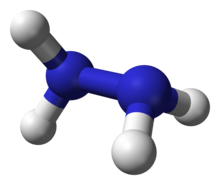
Estructura química de la hidracina
Propiedades
Es un líquido incoloro. Huele como el amoníaco, pero es más reactivo que éste. Es un fuerte agente reductor. Es explosivo. Puede mezclarse con el agua. Es una base similar al amoníaco.
Preparación
Se fabrica haciendo reaccionar hipoclorito de sodio con amoníaco líquido (no doméstico). Si se hace reaccionar con amoníaco doméstico, se desprenden gases tóxicos. Se puede fabricar haciendo reaccionar la urea con el hipoclorito de sodio.
Utiliza
Se utiliza para fabricar espuma. También se utiliza en los combustibles para cohetes. Puede utilizarse en las pilas de combustible. Se utiliza para fabricar azida de sodio mediante la reacción de la amida de sodio con el nitrito de sodio.
Páginas relacionadas
- Amonio
- Azida
- Nitrato
Buscar dentro de la enciclopedia